화학분석기능사(2015. 7. 19.) 시험일자 : 2015년 7월 19일
1과목 : 일반화학
1. 20℃, 0.5atm에서 10L인 기체가 있다. 표준상태에서 이 기체의 부피는?
- ① 2.54L
- ② 4.65L
- ③ 5L
- ④ 10L
go2025. 1. 6. 22:44삭제
https://ywpop.tistory.com/16935
12022. 1. 9. 20:13삭제
- PV/T = P'V'/T'
- (0.5atm) * (10L) / (273+20) = (1atm) * (??L) / (273)
- ?? = 약 4.65L
2. 에탄올에 진한 황산을 넣고 180℃에서 반응시켰을 때 알코올의 제거반응으로 생성되는 물질은?
- ① CH3OH
- ② CH2 = CH2
- ③ CH3CH2CH2SO3
- ④ CH3CH2S
등록된 댓글이 없습니다.
3. 이온 결합에 대한 설명으로 틀린 것은?
- ① 이온 결정은 극성 용매인 물에 잘 녹지 않는 것이 많다.
- ② 전자를 잃은 원자는 양이온이 되고, 전자를 얻은 원자는 음이온이 된다.
- ③ 이온 결정은 고체 상태에서는 양이온과 음이온이 강하게 결합되어 있기 때문에 전류가 흐르지 않는다.
- ④ 전자를 잃기 쉬운 금속 원자로부터 전자를 얻기 쉬운 비금속 원자로 하나 이상의 전자가 이동할 때 형성된다.
등록된 댓글이 없습니다.
4. CO2와 H2O는 모두 공유결합으로 된 삼원자 분자인데 CO2 는 비극성이고 H2O는 극성을 띠고 있다. 그 이유로 옳은 것은?
- ① C가 H보다 비금속성이 크다.
- ② 결합구조가 H2O는 굽은형이고 CO2는 직선형이다.
- ③ H2O의 분자량이 CO2의 분자량보다 적다.
- ④ 상온에서 H2O는 액체이고 CO2는 기체이다.
등록된 댓글이 없습니다.
5. 수산화나트륨(NaOH) 80g을 물에 녹여 전체 부피가 1000mL가 되게 하였다. 이 용액의 N농도는 얼마인가? (단, 수산화나트륨의 분자량은 40 이다.)
- ① 0.08N
- ② 1N
- ③ 2N
- ④ 4N
12022. 1. 9. 20:12삭제
- NaOH의 분자량이 40이니까 40g이 1몰
- NaOH가 80g이 있으니까 2몰을 물에 녹임
- 몰농도 = 몰 / 용액 = 2mol / 1L = 2N
6. 500mL의 물을 증발시키는데 필요한 열은 얼마인가? (단, 물의 증발열은 40.6kJ/mol 이다.)
- ① 222kJ
- ② 1128kJ
- ③ 2256kJ
- ④ 20300kJ
12022. 1. 9. 20:16삭제
- 물의 몰질량 = 2+16 = 18g/mol
- 500g 있다고 했으니까 500/18 하면 27.8몰
- 물의 증발열이 40.6KJ/mol이면 1몰당 40.6인거니까
= 40.6 x 27.8 = 1128
7. 칼륨(K) 원자는 19개의 양성자와 20개의 중성자를 가지고 있다. 원자번호와 질량수는 각각 얼마인가?
- ① 9, 19
- ② 9, 39
- ③ 19, 20
- ④ 19, 39
등록된 댓글이 없습니다.
8. 다음 중 이온화에너지가 가장 작은 원소는?
- ① 나트륨(Na)
- ② 마그네슘(Mg)
- ③ 알루미늄(Al)
- ④ 규소(Si)
12022. 1. 9. 20:17삭제
이온화에너지는 왼쪽으로 갈 수록 커짐! 0족으로
나마알규 니까 나트륨이 제일 왼쪽
9. 벤젠의 반응에서 소량의 철의 존재하에서 벤젠과 염소가스를 반응시키면 수소 원자와 염소 원자의 치환이 일어나 클로로벤젠이 생기는 반응을 무엇이라 하는가?
- ① 니트로화
- ② 술폰화
- ③ 할로겐화
- ④ 알킬화
12022. 1. 9. 20:19삭제
클로로벤젠은 할로겐화 방향족 화합물
10. “어떠한 화학반응이라도 반응물 전체의 질량과 생성물 전체의 질량은 서로 차이가 없고 완전히 같다” 라고 설명할 수 있는 법칙은?
- ① 일정성분비의 법칙
- ② 배수비례의 법칙
- ③ 질량보존의 법칙
- ④ 기체반응의 법칙
등록된 댓글이 없습니다.
11. 다음 중 카르복시기는?
- ① -O-
- ② -OH
- ③ -CHO
- ④ -COOH
등록된 댓글이 없습니다.
12. 다음 유기화합물 중 파라핀계 탄화수소는?
- ① C5H10
- ② C4H8
- ③ C3H6
- ④ CH4
등록된 댓글이 없습니다.
13. 다음 중 성격이 다른 화학식은?
- ① CH3COOH
- ② C2H5OH
- ③ C2H5CHO
- ④ C2H3O2
등록된 댓글이 없습니다.
14. 다음 물질 중 혼합물인 것은?
- ① 염화수소
- ② 암모니아
- ③ 공기
- ④ 이산화탄소
등록된 댓글이 없습니다.
15. 27℃인 수소 4L를 압력을 일정하게 유지하면서, 부피를 2L로 줄이려면 온도를 얼마로 하여야 하는가?
- ① -273℃
- ② -123℃
- ③ 157℃
- ④ 327℃
12022. 1. 9. 20:23삭제
PV/T
P*4/273+27 = P*2/??
4/300 = 2/?
? = 150
273-150= -123
16. 건조 공기 속에서 네온은 0.0018%를 차지한다. 몇 ppm인가?
- ① 1.8ppm
- ② 18ppm
- ③ 180ppm
- ④ 1800ppm
등록된 댓글이 없습니다.
17. 1g의 라듐으로부터 1m 떨어진 거리에서 1시간동안 받는 방사선의 영향을 무엇이라 하는가?
- ① 1 렌트겐
- ② 1 큐리
- ③ 1 렘
- ④ 1 베크렐
등록된 댓글이 없습니다.
18. 다음 중 분자 안에 배위결합이 존재하는 화합물은?
- ① 벤젠
- ② 에틸알콜
- ③ 염소이온
- ④ 암모늄이온
등록된 댓글이 없습니다.
19. 증기압에 대한 설명으로 틀린 것은?
- ① 증기압이 크면 증발이 어렵다.
- ② 증기압이 크면 끓는점이 낮아진다.
- ③ 증기압은 온도가 높아짐에 따라 커진다.
- ④ 증기압이 크면 분자간 인력이 작아진다.
등록된 댓글이 없습니다.
20. 볼타 전지의 음극에서 일어나는 반응은?
- ① 환원
- ② 산화
- ③ 응집
- ④ 킬레이트
등록된 댓글이 없습니다.
2과목 : 분석화학
21. 황산구리 용액에 아연을 넣을 경우 구리가 석출되는 것은 아연이 구리보다 무엇의 크기가 크기 때문인가?
- ① 이온화경향
- ② 전기저항
- ③ 원자가전자
- ④ 원자번호
등록된 댓글이 없습니다.
22. NH4+ 의 원자가전자는 총 몇 개인가?
- ① 7
- ② 8
- ③ 9
- ④ 10
등록된 댓글이 없습니다.
23. 다음 중 1패러데이(F)의 전기량은?
- ① 1mol의 물질이 갖는 전기량
- ② 1개의 전자가 갖는 전기량
- ③ 96500개의 전자가 갖는 전기량
- ④ 1g당량 물질이 생성할 때 필요한 전기량
등록된 댓글이 없습니다.
24. 반응속도에 영향을 주는 인자로서 가장 거리가 먼 것은?
- ① 반응온도
- ② 반응식
- ③ 반응물의 농도
- ④ 촉매
등록된 댓글이 없습니다.
25. 다음 중 콜로이드 용액이 아닌 것은?
- ① 녹말 용액
- ② 점토 용액
- ③ 설탕 용액
- ④ 수산화알루미늄 용액
등록된 댓글이 없습니다.
26. Ni2+ 의 확인반응에서 디메틸글리옥심(dimethylglyoxime)을 넣으면 무슨색으로 변하는 가?
- ① 붉은색
- ② 푸른색
- ③ 검정색
- ④ 하얀색
등록된 댓글이 없습니다.
27. 다음 황화물 중 흑색 침전이 아닌 것은?
- ① PbS
- ② CuS
- ③ HgS
- ④ CdS
등록된 댓글이 없습니다.
28. 양이온의 계통적인 분리 검출법에서는 방해 물질을 제거시켜야 한다. 다음 중 방해 물질이 아닌 것은?
- ① 유기물
- ② 옥살산 이온
- ③ 규산 이온
- ④ 암모늄 이온
등록된 댓글이 없습니다.
29. 중화 적정에 사용되는 지시약으로서 8.3~10.0pH 정도의 변색범위를 가지며 약산과 강염기의 적정에 사용되는 것은?
- ① 메틸옐로
- ② 페놀프탈레인
- ③ 메틸오렌지
- ④ 브롬티몰블루
등록된 댓글이 없습니다.
30. 몰 농도를 구하는 식을 옳게 나타낸 것은?
- ① 몰농도(M) = 용질의몰수(mol)/용액의부피(L)
- ② 몰농도(M) = 용질의몰수(mol)/용매의질량(kg)
- ③ 몰농도(M) = 용질의질량(g)/용액의질량(kg)
- ④ 몰농도(M) = 용질의당량/용액의부피(L)
등록된 댓글이 없습니다.
31. 0.01M Ca2+ 50.0mL 와 반응하려면 0.05M EDTA 몇 mL 가 필요한가?
- ① 10
- ② 25
- ③ 50
- ④ 100
등록된 댓글이 없습니다.
32. 다음 반응에서 정반응이 일어날 수 있는 경우는?
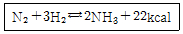
- ① 반응 온도를 높인다.
- ② 질소의 농도를 감소시킨다.
- ③ 수소의 농도를 감소시킨다.
- ④ 암모니아의 농도를 감소시킨다.
등록된 댓글이 없습니다.
33. 다음 수용액 중 산성이 가장 강한 것은?
- ① pH = 5 인 용액
- ② [H+] = 10-8M 인 용액
- ③ [OH-] = 10-4M 인 용액
- ④ pOH = 7 인 용액
등록된 댓글이 없습니다.
34. 용액의 전리도(α)를 옳게 나타낸 것은?
- ① 전리된 몰농도 / 분자량
- ② 분자량 / 전리된 몰농도
- ③ 전체 몰농도 / 전리된 몰농도
- ④ 전리된 몰농도 / 전체 몰농도
등록된 댓글이 없습니다.
35. 제2족 구리족 양이온과 제2족 주석족 양이온을 분리하는 시약은?
- ① HCI
- ② H2S
- ③ Na2S
- ④ (NH4)2CO3
등록된 댓글이 없습니다.
36. 다음 중 건조용으로 사용되는 실험기구는?
- ① 데시케이터
- ② 피펫
- ③ 메스실린더
- ④ 플라스크
등록된 댓글이 없습니다.
37. 25℃에서 용해도가 35 인 염, 20g을 50℃ 의 물 50mL 에 완전 용해시킨 다음 25℃로 냉각하면 약 몇 g의 염이 석출 되는가?
- ① 2.0
- ② 2.3
- ③ 2.5
- ④ 2.8
등록된 댓글이 없습니다.
38. 불꽃반응 색깔을 관찰할 때 노란색을 띠는 것은?
- ① K
- ② As
- ③ Ca
- ④ Na
등록된 댓글이 없습니다.
39. 약염기를 강산으로 적정할 때 당량점의 pH는?
- ① pH 4 이하
- ② pH 7 이하
- ③ pH 7 이상
- ④ pH 4 이상
등록된 댓글이 없습니다.
40. 97wt% H2SO4의 비중이 1.836 이라면 이 용액 노르말 농도는 약 몇 N 인가? (단, H2SO4의 분자량은 98.08 이다.)(오류 신고가 접수된 문제입니다. 반드시 정답과 해설을 확인하시기 바랍니다.)
- ① 18
- ② 36
- ③ 54
- ④ 72
등록된 댓글이 없습니다.
3과목 : 기기분석
41. 빛이 음파처럼 여러 가지 빛이 합쳐 빛의 세기를 증가하거나 서로 상쇄하여 없앨 수 있다. 예를 들면 여러 개의 종이에 같은 물감을 그린 다음 한 장만 보면 연하게 보이지만 여러 장을 겹쳐보면 진하게 보인다. 그리고 여러 가지 물감을 섞으면 본래의 색이 다르게 나타나는 이러한 현상을 무엇이라 하는가?
- ① 빛의 상쇄
- ② 빛의 간섭
- ③ 빛의 이중성
- ④ 빛의 회절
등록된 댓글이 없습니다.
42. 포화 칼로멜(calomel)전극 안에 들어있는 용액은?
- ① 포화 염산
- ② 포화 황산알루미늄
- ③ 포화 염화칼슘
- ④ 포화 염화칼륨
등록된 댓글이 없습니다.
43. 유리 기구의 취급 방법에 대한 설명으로 틀린 것은?
- ① 유리 기구를 세척할 때에는 중크롬산칼륨과 황산의 혼합 용액을 사용한다.
- ② 유리 기구와 철제, 스테인리스강 등 금속재질의 실험 실습 기구는 같이 보관한다.
- ③ 뷰렛, 메스실린더, 피펫 등 눈금이 표시된 유리 기구는 가열하지 않는다.
- ④ 깨끗이 세척된 유리 기구는 유리 기구의 벽에 물방울이 없으며, 깨끗이 세척되지 않은 유리 기구의 벽은 물방울이 남아 있다.
등록된 댓글이 없습니다.
44. 기체 크로마토그래피에서 정지상에 사용하는 흡착제의 조건이 아닌 것은?
- ① 점성이 높아야 한다.
- ② 성분이 일정해야 한다.
- ③ 화학적으로 안정해야 한다.
- ④ 낮은 증기압을 가져야 한다.
등록된 댓글이 없습니다.
45. 과망간산칼륨 시료를 20ppm으로 1L를 만들려고 한다. 이 때 과망간산칼륨을 몇 g 칭량하여야 하는가?
- ① 0.0002g
- ② 0.002g
- ③ 0.02g
- ④ 0.2g
등록된 댓글이 없습니다.
46. 가스 크로마토그래프의 주요 구성부가 아닌 것은?
- ① 운반 기체부
- ② 주입부
- ③ 흡광부
- ④ 컬럼
등록된 댓글이 없습니다.
47. 용액이 산성인지 알칼리성인지 또는 중성인지를 알려면, 용액 속에 들어 있는 공존 물질에는 관계가 없고 용액 중에 [H+] : [OH-]의 농도비로 결정되는데 [H+]>[OH-]의 용액은?
- ① 산성
- ② 알칼리성
- ③ 중성
- ④ 약성
등록된 댓글이 없습니다.
48. 가스크로마토그래피의 검출기 중 불꽃 이온화 검출기에 사용되는 불꽃을 위해 필요한 기체는?
- ① 헬륨
- ② 질소
- ③ 수소
- ④ 산소
등록된 댓글이 없습니다.
49. 가스 크로마토그래피의 시료 혼합 성분은 운반 기체와 함께 분리관을 따라 이동하게 되는데 분리관의 성능에 영향을 주는 요인으로 가장 거리가 먼 것은?
- ① 분리관의 길이
- ② 분리관의 온도
- ③ 검출기의 기록계
- ④ 고정상의 충전 방법
등록된 댓글이 없습니다.
50. 분광광도계를 이용하여 시료의 투과도를 측정한 결과 투과도가 10%T 이었다. 이 때 흡광도는 얼마인가?
- ① 0.5
- ② 1
- ③ 1.5
- ④ 2
등록된 댓글이 없습니다.
51. 다음 중 발화성 위험물끼리 짝지어진 것은?
- ① 칼륨, 나트륨, 황, 인
- ② 수소, 아세톤, 에탄올, 에틸에테르
- ③ 등유, 아크릴산, 아세트산, 크레졸
- ④ 질산암모늄, 니트로셀룰로오스, 피크린산
등록된 댓글이 없습니다.
52. 일반적으로 어떤 금속을 그 금속이온이 포함된 용액 중에 넣었을 때 금속이 용액에 대하여 나타내는 전위를 무엇이라 하는가?
- ① 전극전위
- ② 과전압전위
- ③ 산화ㆍ환원전위
- ④ 분극전위
등록된 댓글이 없습니다.
53. 용액 중의 물질이 빛을 흡수하는 성질을 이용하는 분석기기를 무엇이라 하는가?
- ① 비중계
- ② 용액 광도계
- ③ 액성 광도계
- ④ 분광 광도계
등록된 댓글이 없습니다.
54. 분광광도계의 부분 장치 중 다음과 관련 있는 것은?
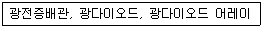
- ① 광원부
- ② 파장선택부
- ③ 시료부
- ④ 검출부
등록된 댓글이 없습니다.
55. 다음의 기호 중 적외선을 나타내는 것은?
- ① VIS
- ② UV
- ③ IR
- ④ X-Ray
등록된 댓글이 없습니다.
56. 가스 크로마토그래피(gas chromatography)로 가능한 분석은?
- ① 정성분석만 가능
- ② 정량분석만 가능
- ③ 반응속도 분석만 가능
- ④ 정량분석과 정성분석이 가능
등록된 댓글이 없습니다.
57. 가시선의 광원으로 주로 사용하는 것은?
- ① 수소 방전등
- ② 중수소 방전등
- ③ 텅스텐 등
- ④ 나트륨 등
등록된 댓글이 없습니다.
58. 가스크로마토그래피(GC)에서 운반가스로 주로 사용되는 것은?
- ① O2, H2
- ② O2, N2
- ③ He, Ar
- ④ CO2, CO
등록된 댓글이 없습니다.
59. 액체-고체 크로마토그래피(LSC)의 분리 메카니즘은?
- ① 흡착
- ② 이온교환
- ③ 배제
- ④ 분배
등록된 댓글이 없습니다.
60. 람베르트-비어 법칙에 대한 설명이 맞는 것은?
- ① 흡광도는 용액의 농도에 비례하고 용액의 두께에 반비례한다.
- ② 흡광도는 용액의 농도에 반비례하고 용액의 두께에 비례한다.
- ③ 흡광도는 용액의 농도와 용액의 두께에 비례한다.
- ④ 흡광도는 용액의 농도와 용액의 두께에 반비례한다.
등록된 댓글이 없습니다.