화학분석기능사(2004. 7. 18.) 시험일자 : 2004년 7월 18일
1과목 : 일반화학
1. 0℃, 1기압에서 1m3의 아세틸렌을 얻으려면 순도 85%의 탄화칼슘 몇 ㎏이 필요한가? (단, 탄화칼슘 분자량은 64이다.)
- ① 1.4㎏
- ② 3.36㎏
- ③ 5.29㎏
- ④ 11.2㎏
등록된 댓글이 없습니다.
2. 산이나 알칼리에 반응하여 수소를 발생시키는 것은?
- ① Mg
- ② Si
- ③ Al
- ④ Fe
등록된 댓글이 없습니다.
3. 원자번호 18번인 아르곤(Ar)의 질량수가 25일 때 중성자수의 개수는?
- ① 7
- ② 8
- ③ 42
- ④ 43
등록된 댓글이 없습니다.
4. 두 원자 사이에서 극성 공유 결합한 것으로 구조가 대칭이 되므로 비극성 분자인 것은?
- ① CCl4
- ② CHCl3
- ③ CH2Cl2
- ④ CH3Cl
등록된 댓글이 없습니다.
5. 기체는 어느 경우에 물에 잘 녹는가?
- ① 압력, 온도가 모두 낮을 때
- ② 압력, 온도가 모두 높을 때
- ③ 압력은 낮고, 온도가 높을 때
- ④ 압력은 높고, 온도가 낮을 때
등록된 댓글이 없습니다.
6. 납축전지 속에서는 전체적으로 다음 반응이 일어난다. 방전할 때 (-)극에서 일어나는 반응은?
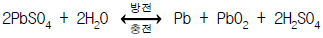
- ① PbO2 + 4H+ + SO42- + 2e- → PbSO4 + 2H2O
- ② PbSO4 + 2e- → Pb + SO42-
- ③ PbSO4 + 2H2O → PbO2 + 4H+ + SO42- + 2e-
- ④ Pb + SO42- → PbSO4 + 2e-
등록된 댓글이 없습니다.
7. 다음 유기화합물 중 반응성이 가장 큰 것은?(오류 신고가 접수된 문제입니다. 반드시 정답과 해설을 확인하시기 바랍니다.)
- ① CH4
- ② C2H6
- ③ C2H4
- ④ C2H2
등록된 댓글이 없습니다.
8. 6M HNO3 100mL을 만드는데 필요한 질산의 무게와 부피를 계산하면 다음 어떤 것인가? (단, 70% HNO3이고, 20℃일 때 밀도 1.4g/mL, 분자량은 63 임)
- ① 54g, 38.3mL
- ② 70g, 50mL
- ③ 37.8g, 50mL
- ④ 50g, 37.8mL
등록된 댓글이 없습니다.
9. 탄산음료수의 병마개를 개방하면 왜 거품(기포)이 솟아오르는가?
- ① 수증기가 생기기 때문이다.
- ② 이산화탄소가 분해하기 때문이다.
- ③ 온도가 올라가게 되어 용해도가 증가하기 때문이다.
- ④ 액체 위의 압력이 줄어들어 용해도가 줄기 때문이다.
등록된 댓글이 없습니다.
10. 다음은 산성의 강약을 표시한 것이다. 잘못 표시된 것은?
- ① H3AsO3 < H3AsO4
- ② HNO2 < HNO3
- ③ HMnO4 < H2MnO4
- ④ HClO < HClO4
등록된 댓글이 없습니다.
11. 다음 반응식중에서 첨가 반응에 해당되는 것은?
- ① 3C2H2 → C6H6
- ② C2H4 + Br2 → C2H4Br2
- ③ C2H5OH → C2H4 + H2O
- ④ CH4 + Cl2 → CH3Cl + HCl
등록된 댓글이 없습니다.
12. 다음 A, B는 어떤 중성 원자의 전자 배치의 두가지 경우를 표시한 것이다. 이중 잘못 설명한 것은?

- ① 전자 1개를 분리시키는데 A원자가 B원자보다 많은 에너지가 필요하다.
- ② B의 상태는 A의 상태보다 원자로서 높은 에너지 상태에 있다.
- ③ B가 A로 변할때는 빛이 방출된다.
- ④ A와 B는 서로 다른 원소이다.
등록된 댓글이 없습니다.
13. 녹말을 염산과 더불어 가수분해 할 때 마지막으로 생성되는 물질은?
- ① C12H22O11
- ② C6H10O6
- ③ (C6H10O5)n
- ④ C6H12O6
등록된 댓글이 없습니다.
14. 다음 물질 중 분산력 (반데르발스힘)이 가장 큰 물질은?
- ① CH4
- ② SiH4
- ③ CF4
- ④ CCl4
등록된 댓글이 없습니다.
15. 농도를 모르는 HCl(염산) 50mL를 완전히 중화하는데 0.2M NaOH(수산화나트륨)100mL가 필요했다면 이 염산의 몰농도(M)는 얼마인가?
- ① 0.1M
- ② 0.2M
- ③ 0.3M
- ④ 0.4M
등록된 댓글이 없습니다.
16. 다음 중 상온(25℃)에서 물 또는 습기와 접촉하여 발화하는 금속은?
- ① Na
- ② Si
- ③ Cu
- ④ Be
등록된 댓글이 없습니다.
17. 다음 중 같은 양의 물과 함께 넣어 흔들면 섞이지 않고 상층액으로 분리되는 것은?
- ① 에탄올
- ② 에테르
- ③ 포름산
- ④ 아세트산
등록된 댓글이 없습니다.
18. 물, 벤젠, 석유의 3가지 용매가 있다. 이 중 서로 혼합 되는 것으로만 짝지워진 것은?
- ① 물, 벤젠
- ② 물, 석유
- ③ 벤젠, 석유
- ④ 물, 벤젠, 석유
등록된 댓글이 없습니다.
19. 다음 중 극성분자는 어느 것인가?
- ① H2
- ② O2
- ③ H2O
- ④ CH4
등록된 댓글이 없습니다.
20. 공업적으로 에틸렌을 진한 황산과 반응시키면 에틸황산(C2H5OSO3H)이 생긴다 이것을 가수 분해하면 생성되는 물질은?
- ① 메탄올
- ② 페놀
- ③ 에탄올
- ④ 초산
등록된 댓글이 없습니다.
2과목 : 분석화학
21. 양성자 6개, 중성자가 7개 들어 있는 원자의 원자번호는 얼마인가?
- ① 6
- ② 7
- ③ 10
- ④ 13
등록된 댓글이 없습니다.
22. 화학반응시 촉매 역할을 옳게 설명한 것은?
- ① 정반응의 속도는 증가시키나 역반응의 속도는 감소시킨다.
- ② 활성화에너지를 증가시켜 반응속도를 빠르게 한다.
- ③ 정반응의 속도는 감소시키나 역반응의 속도는 증가시킨다.
- ④ 활성화에너지를 감소시켜 반응속도를 빠르게 한다.
등록된 댓글이 없습니다.
23. 다음 중 수소결합에 대한 설명으로 틀린 것은?
- ① 원자와 원자사이의 결합이다.
- ② 전기음성도가 큰 F, O, N의 수소화합물에 나타난다.
- ③ 수소결합을 하는 물질은 수소결합을 하지 않는 물건에 비해 녹는점과 끓는점이 높다.
- ④ 대표적인 수소결합 물질로는 HF, H2O, NH3등이 있다.
등록된 댓글이 없습니다.
24. 할로겐원소의 성질 중 원자번호가 증가할수록 작아지는 것은?
- ① 금속성
- ② 반지름
- ③ 이온화에너지
- ④ 녹는점
등록된 댓글이 없습니다.
25. 보기중에서 Na와 반응하여 H2를 생성시키고, 은거울반응을 하는 것은?
- ① CH3COOH
- ② CH3CH3
- ③ HCHO
- ④ HCOOH
등록된 댓글이 없습니다.
26. AgCl의 용해도가 0.0016g/L 일 때 AgCl의 용해도 곱은 얼마인가? (단, Ag의 원자량은 108, Cl의 원자량은 35.5임)
- ① 1.12 × 10-5
- ② 1.12 × 10-3
- ③ 1.2 × 10-5
- ④ 1.2 × 10-10
등록된 댓글이 없습니다.
27. 중성에서 KMnO4 1g 당량은 몇 g 인가? (단, KMnO4 = 158.03)
- ① 88.92
- ② 75.03
- ③ 69.15
- ④ 52.68
등록된 댓글이 없습니다.
28. KMnO4 표준용액으로 적정할 때 HCl 산성으로 하지 않는 이유는?
- ① MnO2가 생성 함으로
- ② Cl2가 발생함으로
- ③ 높은 온도로 가열해야 함으로
- ④ 종말점 판정이 어렵다
등록된 댓글이 없습니다.
29. 다음 이온곱과 용해도곱 상수(Ksp)의 관계중에서 침전을 생성시킬수 있는 관계는 어느 것인가?
- ① 이온곱 > Ksp
- ② 이온곱 = Ksp
- ③ 이온곱 < Ksp
- ④ 이온곱 = Ksp × 해리상수
등록된 댓글이 없습니다.
30. 다음 수산화물 중 공기중에서 방치하면 불안정하여 검은 갈색으로 변화되는 것은?
- ① Cu(OH)2
- ② Pb(OH)2
- ③ Fe(OH)3
- ④ Cd(OH)2
등록된 댓글이 없습니다.
31. 유기정성의 위험에 대한 주의사항 중 가장 올바른 것은?
- ① 인화성 액체는 보통 1L∼2L 정도 채취하여 실습에 임한다.
- ② 인화성 물질은 1회 적정시 3g정도 채취하여 실습한다
- ③ 염소나 브롬 등 독가스를 마셨을 때는 에틸알코올을 마신다.
- ④ 디아조염이나 니트로 화합물은 경제적으로 이득이 있게 다량 채취하여 실습한다.
등록된 댓글이 없습니다.
32. 염화물 침전을 세척할 때 세척액으로 가장 적당한 것은?
- ① 묽은 NH4OH
- ② 묽은 HCl
- ③ 묽은 KCN
- ④ 더운 물
등록된 댓글이 없습니다.
33. 제5족 양이온의 분리검출에 쓰이는 분족시약은?
- ① (NH4)2CO3 + NH4Cl
- ② (NH4)2CO + NH4OH
- ③ ZnCO3 + NH4Cl
- ④ ZnCO3 + NH4OH
해설2022. 1. 16. 09:47삭제
https://ywpop.tistory.com/20399
34. 과망간산칼륨이온(MnO4-)은 진한 보라색을 가지는 대표적 산화제이며, 센 산성용액(pH ≤ 1)에서는 환원제와 반응하여 무색의 Mn2+으로 환원된다. 1몰(mol)의 과망간산이온이 반응하였을 때, 몇 당량에 해당하는 산화가 일어나게 되는가?
- ① 1
- ② 3
- ③ 5
- ④ 7
해설2022. 3. 16. 22:29삭제
https://ywpop.tistory.com/20639
35. 바닷물 중의 염소이온을 정량할 때에는 은법적정을 이용한다. 이 때 적정반응은 다음 중 어느 것인가?
- ① Na++ Cl- → NaCl
- ② Na++ NO3- → NaNO3
- ③ Ag++ Cl- → AgCl
- ④ Ag++ NO3- → AgNO3
등록된 댓글이 없습니다.
36. EDTA 적정법에서 역적정을 이용하는 경우가 아닌 것은?
- ① 시료 중 금속이온이 지시약과 반응하는 경우.
- ② 사용 할 적당한 지시약이 없는 금속이온을 분석할 경우.
- ③ 시료 중 금속이온이 EDTA를 가하기 전에 침전물을 형성하는 경우.
- ④ 시료 중 금속이온이 적정조건에서 EDTA와 너무 천천히 반응하는 경우.
등록된 댓글이 없습니다.
37. 다음 중 산화-환원 지시약이 아닌 것은?
- ① 디페닐아민
- ② 디클로로메탄
- ③ 페노사프라닌
- ④ 메틸렌 블루
등록된 댓글이 없습니다.
38. 다음은 한 반응의 평형상수 값들이다. 반응 물질이 생성물로 가장 많이 변한 것은 어느 것인가?
- ① 0
- ② 1.0
- ③ 10-2
- ④ 10
등록된 댓글이 없습니다.
39. 20% NaOH 용액 10g을 중화하는데 0.5N HCl 몇 mL가 필요한가?
- ① 50mL
- ② 100mL
- ③ 150mL
- ④ 200mL
등록된 댓글이 없습니다.
40. 아세트산의 이온이 물분자와 반응하여 다음과 같이 진행되는데, 이 반응을 무엇이라고 하는가?
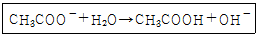
- ① 가수분해
- ② 중화반응
- ③ 축합반응
- ④ 첨가반응
등록된 댓글이 없습니다.
3과목 : 기기분석
41. 다음은 광전 비색계를 이용한 물질의 농도 측정과정을 기술한 것이다. 그 순서가 올바른 것은?

- ① ㉢-㉡-㉠-㉣
- ② ㉡-㉢-㉠-㉣
- ③ ㉢-㉠-㉡-㉣
- ④ ㉠-㉣-㉢-㉡
등록된 댓글이 없습니다.
42. pH4인 용액과 pH6인 용액의 농도차는 얼마인가?
- ① 1/2 배
- ② 1/200 배
- ③ 2 배
- ④ 100 배
등록된 댓글이 없습니다.
43. 전위차 적정의 원리식(Nernst식)에서 n은 무엇을 의미하는가?
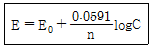
- ① 표준전위차
- ② 단극전위차
- ③ 이온의 농도
- ④ 금속의 산화수 변화
등록된 댓글이 없습니다.
44. 금속에 빛을 조사하면 빛의 에너지를 흡수하여 금속 중의 자유전자가 금속표면에 방출되는 성질은?
- ① 광전효과
- ② 틴들현상
- ③ Ramann효과
- ④ 브라운운동
등록된 댓글이 없습니다.
45. 종이크로마토그래피 조작에서 Rf(rate of flow)의 정의를 올바른게 표현한 것은?
- ① Rf = 기본선과 물질사이의 거리(cm)/기본선과 용매가 스며든 앞 끝까지의 거리(cm)
- ② Rf = (용매가 스며든거리(cm)-물질이 스며든거리(cm))/기본선과 용매가 스며든 앞 끝까지의 거리(cm)
- ③ Rf = 시료의 농도/전개액의 농도
- ④ Rf = 기본선과 용매가 스며든 앞 끝까지의 거리(cm)/기본선과 물질 사이의 거리(cm)
등록된 댓글이 없습니다.
46. 일반적으로 화학 실험실에서 발생하는 실험 폭발 사고의 유형이 아닌 것은?
- ① 조절 불가능한 발열반응
- ② 이산화탄소 누설에 의한 폭발
- ③ 불안전한 화합물의 가열, 건조, 증류 등에 의한 폭발
- ④ 에테르 용액 증류시 남아 있는 과산화물에 의한 폭발
등록된 댓글이 없습니다.
47. 가스크로마토그래피의 정량 분석에 일반적으로 많이 사용되는 방법은?
- ① 크로마토그램의 무게
- ② 크로마토그램의 면적
- ③ 크로마토그램의 높이
- ④ 크로마토그램의 머무름 시간
등록된 댓글이 없습니다.
48. 다음 ( )에 들어갈 용어는?

- ① 밀도
- ② 부피
- ③ 압력
- ④ 온도
등록된 댓글이 없습니다.
49. 아베굴절계를 사용한 굴절률 측정에 관한 설명으로 틀린것은?
- ① 굴절률과 농도의 상관관계로 검량선을 그려 시료의 농도를 구한다.
- ② 굴절률은 온도와는 무관하므로 항온장치는 사용하지 않는다.
- ③ 프리즘 사이에 시료용액을 떨어뜨려 빛을 굴절시킨다
- ④ 사용하는 빛은 Na증기램프의 D-선이다.
등록된 댓글이 없습니다.
50. pH미터의 측정원리에 대한 설명으로 맞는 것은?
- ① 탄소전극의 전기 저항
- ② 수은전극의 전해 전류
- ③ 유리전극과 비교전극 간의 전위차
- ④ 백금전극과 유리전극 간의 전위차
등록된 댓글이 없습니다.
51. 가스크로마토그래피에 대한 설명이 틀린 것은?
- ① 운반가스는 일정한 유량으로 흘러야 한다.
- ② 일반적으로 유기화합물에 대한 정성 및 정량분석에 이용한다.
- ③ 시료도입부, 분리관, 검출기 등은 필요한 온도로 유지해 주어야 한다.
- ④ 충진물로 흡착성 고체분말을 사용한 것을 기체-액체 크로마토그래피라 한다.
등록된 댓글이 없습니다.
52. pH 미터를 보정할 때 사용하는 완충 용액이 아닌 것은?
- ① 옥살산염 표준용액
- ② 프탈산염 표준용액
- ③ 중성 염산 표준용액
- ④ 중성 인산염 표준용액
등록된 댓글이 없습니다.
53. 다음 정량분석방법 중 여러가지 방해작용이 우려 될 경우에 사용하는 적당한 분석방법은?
- ① 검량선법(표준 검정 곡선법)
- ② 내부표준법
- ③ 표준물첨가법
- ④ 면적백분율법
등록된 댓글이 없습니다.
54. 전기분해반응 Pb2+ + 2H2O ⇄ PbO2(s) + H2(g) + 2H+에서 0.1A의 전류가 20분 동안 흐르다면, 약 몇 g의 PbO2가 석출되겠는가? (단, PbO2의 분자량은 239로 한다.)
- ① 0.10g
- ② 0.15g
- ③ 0.20g
- ④ 0.30g
등록된 댓글이 없습니다.
55. HPLC(고성능액체크로마토그래피)의 기기구성요소 중에서 실질적인 시료의 분리가 일어나는 곳은?
- ① 펌프(Pump)
- ② 컬럼(Column)
- ③ 오븐(Oven)
- ④ 검출기(Detector)
등록된 댓글이 없습니다.
56. 다음 보기 중 GC(기체크로마토그래피)의 검출기가 갖추어야 할 조건으로 적당한 것은?

- ① 1, 2, 3
- ② 1, 3, 5
- ③ 2, 4, 5
- ④ 1, 2, 5
등록된 댓글이 없습니다.
57. 분자량이 292.16인 화합물을 5mL 메스플라스크에 녹였다. 이 중 1mL 를 분취하여 10mL 메스플라스크에 묽힌 후, 340nm 에서 1.00cm 셀로 측정한 흡광도가 0.613 이었다면, 5mL 플라스크중에 있는 시료의 몰농도는? (몰흡광계수 ε 340 = 6130 M-1ㆍcm-1)
- ① 1.0 × 10-4M
- ② 5.0 × 10-4M
- ③ 1.0 × 10-3M
- ④ 5.0 × 10-3M
등록된 댓글이 없습니다.
58. 원자흡수분광법의 광원인 Hollow Cathode Lamp(속빈음극램프)의 충진가스로 적당한 것은?
- ① Ne
- ② H2
- ③ N2
- ④ C2H2
등록된 댓글이 없습니다.
59. 전지를 구성할 때, 양극에서 일어나는 반응은?
- ① 환원반응
- ② 산화반응
- ③ 중화반응
- ④ 침전반응
등록된 댓글이 없습니다.
60. 폴라로그래피에서 얻은 폴라로그램 중 어느 것을 정성분석에 이용하는가?
- ① 한계 전류
- ② 확산 전류
- ③ 반파 전위
- ④ 산소파
등록된 댓글이 없습니다.