화학분석기사(2010. 5. 9.) 시험일자 : 2010년 5월 9일
1과목 : 일반화학
1. 카르보닐(carbonyl)기를 가지고 있지 않은 것은?
- ① 알데히드
- ② 아미드
- ③ 에스테르
- ④ 페놀
등록된 댓글이 없습니다.
2. 25℃에서 용해도곱 상수(Ksp)가 1.6x10-5일 때, 염화 납(II)(PdCl2)의 용해도(mo/L)는 얼마인가?
- ① 1.6×10-2
- ② 0.020
- ③ 7.1×10-5
- ④ 2.1
등록된 댓글이 없습니다.
3. 원자에 대한 설명 중 틀린 것은?
- ① 수소원자(H)는 1개의 중성자와 1개의 양성자 그리고 1개의 전자로 이루어져 있다.
- ② 수소원자에서 전자가 빠져나가면 수소이온 (H+)이 된다.
- ③ 수소원자에서 전자가 빠져나간 것이 양성자이다.
- ④ 탄소의 경구처럼 수소 역시 동위원소들이 존재한다.
등록된 댓글이 없습니다.
4. 전지에 대한 설명 중 틀린 것은?
- ① 불타전지는 자발적으로 작동되는 전기화학 전지이다.
- ② 전지에서 산화가 일어나는 전극에서는 전자를 낸다.
- ③ 볼타전지에서 산화가 일어나는 전극은 아연전극이다.
- ④ 전해전지에서 산화환원반응을 일어나게 하기 위해서는 전기에너지가 필요 없다.
등록된 댓글이 없습니다.
5. 525℃에서 다음 반응에 대한 평형상수 K값은 3.35×10-3mol/L이다. 이 때 평형에서 이산화탄소 농도를 구하면 얼마인가?
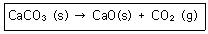
- ① 0.84×10-3mol/L
- ② 1.68×10-3mol/L
- ③ 3.35×10-3mol/L
- ④ 6.77×10-3mol/L
등록된 댓글이 없습니다.
6. 유기화합물의 이름이 틀린 것은?
- ① CH3-(CH2)4-CH3:헥산
- ② C2H5OH:에틸알코올
- ③ C2H5OC2H5:디에틸에테르
- ④ H-COOH:벤조산
등록된 댓글이 없습니다.
7. C6H14의 분자시을 가지는 화합물은 몇 가지 구조이성질체가 가능한가?
- ① 3
- ② 4
- ③ 5
- ④ 6.
등록된 댓글이 없습니다.
8. 다음 반응이 일어난다고 할 때 산화되는 물질은?
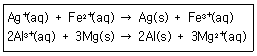
- ① Ag+(aq), Al3+(aq)
- ② Fe2+(aq), Mg(s)
- ③ Ag+(aq), Mg(s)
- ④ Fe2+(aq), Al3+(aq)
등록된 댓글이 없습니다.
9. 다음 중 산의 세기가 가장 강한 것은?
- ① HCIO
- ② HF
- ③ CH3COOH
- ④ HCI
등록된 댓글이 없습니다.
10. 15℃에서 물의 이온화상수 Kw 는 0.45 × 10-14 이다. 15℃에서 물 속의 H3O+의 농도(M)는?
- ① 1.0×10-7
- ② 1.5×10-7
- ③ 6.7×10-8
- ④ 4.2×10-15
등록된 댓글이 없습니다.
11. 용해도에 관한 설명 중 틀린 것은?
- ① 특별한 조건에서 용액의 최대 용해도를 초과한 용액을 과포화되었다고 한다.
- ② 어떤 주어진 온도에서 최대로 녹을 수 있는 용질의 양을 포함하는 용액을 포화되었다고 한다.
- ③ 일반적으로 고체화합물의 용해도는 용액의 온도가 올라가면 감소한다.
- ④ 용액의 농도가 용액의 최대 용해도보다 적을 때는 불포화 되었다고 한다.
등록된 댓글이 없습니다.
12. 다음 물질의 극성에 관한 설명 중 틀린 것은?
- ① 물은 극성 물질이다.
- ② 염화수소는 극성 물질이다.
- ③ 암모니아는 비극성 물질이다.
- ④ 이산화탄소는 비극성 물질이다.
등록된 댓글이 없습니다.
13. 황산구리(II) 수용액을 통하여 2A 의 전류를 약 몇 초간 흘려주어야 1.36g 의 구리가 석출되는가? (단, 1F는 96500C/mol이며, 구리의 원자량은 63.5이다.)
- ① 736
- ② 1033
- ③ 2065
- ④ 2567
등록된 댓글이 없습니다.
14. 스티렌(Styrene)의 실험식은 CH이고, 이것의 분자량은 약 104.1g/mol이다. 이 화합물의 분자식은?
- ① C2H4
- ② C8H8
- ③ C10H12
- ④ C6H6
등록된 댓글이 없습니다.
15. 순도가 96wt% 인 진한 황상용액의 몰랄농도는 약 몇 m 인가? (단, 원자량은 K가 39.10, 0는 16.00, H는 1.008, S는 32.06이다.)
- ① 20
- ② 135
- ③ 200
- ④ 245
등록된 댓글이 없습니다.
16. 몰랄농도가 3,24m 인 K2S04 수용액 내 K2SO4의 몰분율은? (단, 원자량은 K가 39.10, 0는 16.00, H는 1.008, S는 32.06이다.)
- ① 0.36
- ② 0.036
- ③ 0.551
- ④ 0.0551
등록된 댓글이 없습니다.
17. 다원자 이온 중 명명법이 틀린 것은?
- ① 아염소산=CIO-
- ② 아황산=SO32-
- ③ 염소산=CIO3-
- ④ 과염소산=CIO4-
등록된 댓글이 없습니다.
18. 수용액 중 H+ 이온의 농도가 0.1M 이다. H+이온의 농도를 pH 로 나타내면?
- ① 0.01
- ② 0.1
- ③ 1
- ④ 10
등록된 댓글이 없습니다.
19. 다음 중 수소의 지량 백분율(%)아 가장 큰 것은?
- ① HCI
- ② H2O
- ③ H2SO4
- ④ H2S
등록된 댓글이 없습니다.
20. 탄소와 수소로만 이루어진 탄화수소 중 탄소의 질량 백분율이 85.6% 인 화합물의 실헙식은?
- ① CH
- ② CH2
- ③ C3H
- ④ C6H
등록된 댓글이 없습니다.
2과목 : 분석화학
21. 0.18M NaCl 용액에 담겨있는 은 전극의 전위는? (단, Nernst 식에서 (RT/F)=0.5916V이며 기준전극은 표준수소전극(SHE)이고, Ag++e-⇄Ag(s)에 대한 표준전극전위 E0는 0.799V, AgCl의 용해도곱상수 Ksp는 1.8×10-8이다.)
- ① 0.085
- ② 0.185
- ③ 0.285
- ④ 0.385
등록된 댓글이 없습니다.
22. EDTA(etylenediaminetetraacetic acid, H4Y)를 이용한 금속이온 적정에 대한 설명 중 올바른 것은?
- ① EDTA(H4Y) 착물형성 반응에 pH와 관계없이 관여하는 화학종은 H2Y2-이다.
- ② EDTA(H4Y) 착물형성 반응에 관여하는 화학종은 Y4-이다.
- ③ EDTA(H4Y) 착물형성 반응은 pH가 낮을 경우에만 화학종이 Y4-이 관여한다.
- ④ EDTA(H4Y) 착물형성 반응은 pH가 높을 경우에만 화학종 H2Y2-이 관여한다.
등록된 댓글이 없습니다.
23. EDTA를 이용한 금속이온 적정에서 보조 착염제(auxiliary complexing agent)에 대한 설명 중 틀린 것은?
- ① 주로 알칼리성 용액에서 적정할 때 사용한다.
- ② EDTA가 없을 때 금속이온이 수산화물로 침전되는 것은 막아준다.
- ③ 보조 착염제와 금속이온과의 형성상수가 EDTA와 금속이온의 형성상수보다 커야 한다.
- ④ 암모니아가 보조 착염제로 많이 사용된다.
등록된 댓글이 없습니다.
24. 20℃에서 빈 플라스크의 질량은 10.2634g 이고, 증류스로 플라스크를 완전히 채운 후에 질량은 20.2144g 이었다. 20℃에서 물 1g의 부피가 1.0029ml 일 때, 이 플라스크의 부피를 나타내는 식은 무엇인가?
- ① (20.2144-10.2634)×1.0029
- ② (20.2144-10.2634)÷1.0029
- ③ 1.0029+(20.2144-10.2634)
- ④ 1.0029÷(20.2144-10.2634)
등록된 댓글이 없습니다.
25. 다음 반응에서 염기-짝산과 산-짝염기 쌍을 각각 옳게 나타낸 것은?
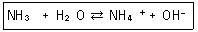
- ① NH3-OH-, H2O-NH4+
- ② NH3-NH4+, H2O-OH-
- ③ H2O-NH3, NH4+-OH-
- ④ H2O-NH4+, NH3-OH-
등록된 댓글이 없습니다.
26. 산화-환원적정에서 산화제 자신이 지시약으로 작용하는 산화제는?
- ① 시륨 이온(Ce4+)
- ② 아이오딘(I2)
- ③ 과망간산 이온(MnO4-)
- ④ 중크롬산 이온(Cr2O72-)
등록된 댓글이 없습니다.
27. 염산의 표준화를 위하여 사용하는 탄산나트륨을 완전히 건조하지 않았다면 표준화된 염산의 농도는 완전히 건조한 (무수)탄산나트륨을 사용하여 표준화했을 때의 염산 농도에 비해 어떻게 되는가?
- ① 높게 된다.
- ② 낮게 된다.
- ③ 탄산나트륨에 있는 물의 양과 무관하다.
- ④ 같은 농도를 갖는다.
등록된 댓글이 없습니다.
28. 다음의 단위 변화에서 알맞은 숫자를 차례대로 나타낸 것은 무엇인가?

- ① 0.532, 2.0×109, 5.0
- ② 53.2, 2.0×109, 5.0×10-3
- ③ 53.2, 2.0×10-9, 5.0
- ④ 53.2, 2.0×10-9, 5.0×10-3
등록된 댓글이 없습니다.
29. S4O62- 이온에서 황(S)의 산화수는 얼마인가?
- ① 2
- ② 2.5
- ③ 3
- ④ 3.5
등록된 댓글이 없습니다.
30. Mn2+가 들어 있는 시료용액 50ml를 0.1M EDTA 용액 100ml와 반응시켰다. 모든 Mn2+와 반응하고 남은 여분의 EDTA를 금속지시약을 사용하여 0.1M Mg2+용액으로 적정하였더니 당량점까지 50ml가 소비되었다. 시료용액에 들어있는 Mn2+의 농도는 몇 M인가?
- ① 0.1
- ② 0.2
- ③ 0.3
- ④ 0.4
등록된 댓글이 없습니다.
31. 갈바니전지를 선 표시법으로 옳게 나타낸 것은?
- ① Cd(s)║CdCl2(aq)|AgNO3(aq)║Ag(s)
- ② Cd(s)|CdCl2(aq), ║AgNO3(aq)|Ag(s)
- ③ Cd(s), CdCl2(aq), AgNO3(aq), Ag(s)
- ④ Cd(s), CdCl2(aq)|AgNO3(aq), Ag(s)
등록된 댓글이 없습니다.
32. 다음 중 산화전극(anode)에서 일어나는 반응이 아닌 것은?
- ① Ag+e-→Ag(s)
- ② Fe2+→Fe3++e-
- ③ Fe(CN)64-→Fe(CN)63-+e-
- ④ Ru(NH3)62+→Ru(NH3)63++e-
등록된 댓글이 없습니다.
33. NaF와 NaClO4이 0.050M 녹아 있는 두 수용액에서 각각 불화칼슘(Ca2++2F-)을 포화용액으로 만들었다. 각 용액에 녹은 칼슘 이온(Ca2+)의 몰 농도(M)의 비율 은? (단. 용액의 이온세기가 0.050M일 때, 활동도계수 =0.485, γF=0.81이고, CaF2의 용해도곱상수 KSP=3.9×10-11이다.)
- ① 23
- ② 123
- ③ 1568
- ④ 6326
등록된 댓글이 없습니다.
34. EDTA(etylenediaminetetraacetic acid, H4Y)를 이용한 금속 Mn+ 적정으로 조건 형성상수(conditional formation constant) Kf'에 대한 설명 중 잘못된 것은? (단, Kf는 형성상수이다.)
- ① EDTA(H4Y) 화학종중 [Y4-]의 농도 분율을 αY4-로 나타내면, αY4-=[Y4-]/[EDTA]이고, Kf'=αY4-Kf이다.
- ② Kf'는 특정한 pH에서 MYn-4의 형성을 의미한다.
- ③ Kf'를 이용하면 해리된 EDTA의 각각의 이온농도를 계산할 수 있다.
- ④ Kf'를 이용하면 해리된 EDTA의 각각의 이온농도를 계산할 수 있다.
등록된 댓글이 없습니다.
35. 산/염기 적정에 관한 설명으로 옳은 것은?
- ① 약산의 해리상수 Ka의 양은 대수인 pKa는 양의 값을 가지며, pKa가 큰 값일수록 강산이다.
- ② 유기산의 pKa가 큰 값일수록 해리 분율이 크다.
- ③ 약산을 강염기로 정정시에 당량점의 pH는 7보다 큰 값으로 산성을 나타낸다.
- ④ 0.10M이 양성자산 H2A(Ka1/Ka2>104) 10.0mL를 0.075M KOH로 적정할 때 적정곡선(pH vs. KOH의 적정량)은 2개의 변곡점을 나타낸다.
등록된 댓글이 없습니다.
36. Br-를 함유한 용액 10.00ml를 과량의 AgNO3로 처리하여 0.5g의 AgBr을 침전시켰다. 미지시료 중의 Br-의 물농도는 약 몇 M 인가? (단, AgBr의 화학식량을 187.77g/mol이다.)
- ① 0.266
- ② 0.133
- ③ 0.0266
- ④ 0.0133
등록된 댓글이 없습니다.
37. 0.1M의 Fe2+ 50mL를 0.1M의 TI3+로 적저한다. 반응식과 각각의 표준환원전위가 다음과 같을 때 당량점에서 전위(V)는 얼마인가?
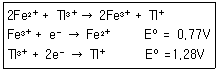
- ① 0.94
- ② 1.02
- ③ 1.11
- ④ 1.20
등록된 댓글이 없습니다.
38. 0.5M Na2S04 용액의 이온세기는 얼마인가?
- ① 0.05M
- ② 0.10M
- ③ 0.15M
- ④ 0.20M
등록된 댓글이 없습니다.
39. 부피분석의 한 가지 방법으로 용액 중의 어떤 물질에 대하여 표준용액을 과잉으로 가하여, 분석물질과의 반응이 완결된 다음 미반응의 표준용액을 다른 표준용액으로 적정하는 방법은?
- ① 정적방법
- ② 후적정법
- ③ 직접적정법
- ④ 역적정법
등록된 댓글이 없습니다.
40. 다음 중 염기로 작용하지 않는 것은?
- ① H2N-CH2CH2CH3
- ②
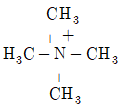
- ③
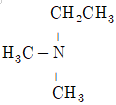
- ④
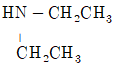
등록된 댓글이 없습니다.
3과목 : 기기분석I
41. 적외선흡수스펙트럼에서 흡수 봉우리의 파수는 화학결합에 대한 힘 상수의 세기와 유효질량에 의존한다. 다음 중 흡수 파수가 가장 클 것으로 예상되는 신축 진동은?
- ① ≡C-H
- ② ≡C-H
- ③ -C-H
- ④ -C≡C-
등록된 댓글이 없습니다.
42. 전자기복사선을 이용하는 일반 분광광도법에 사용되는 분광법의 종류와 그 파장범위가 옳지 않게 짝지어진 것은?
- ① 전자스핀공명-3mm
- ② 핵자기공명-0.6~10m
- ③ X-선 흡수, 방출, 형광 및 회절-0.1~100Å
- ④ 자외선과 가시선 흡수, 방출 및 형광-180~780m
등록된 댓글이 없습니다.
43. 전열 원자화장치의 성능 특성에 대한 설명으로 틀린 것은?
- ① 측정농도 범위가 보통 102정도로 좁다.
- ② 보통 원소당 수 분씩 걸릴 정도로 느리다.
- ③ 큰 부피의 사료에서도 매우 높은 감도를 나타낸다.
- ④ 불꽃이나 플라스마 원자화장치가 적당한 검출한계를 나타내지 못할 경우에만 사용한다.
등록된 댓글이 없습니다.
44. X선 형광법(XRF)에 대한 설명으로 틀린 것은?
- ① 실험과정이 빠르고 편리하다.
- ② 원자번호가 작은 가벼운 원소 측정에 편리하다.
- ③ 비파괴 분석법이어서 시료에 손상을 주지 않는다.
- ④ 스펙트럼이 비교적 단순하여 스펙트럼선 방해 가능성이 적다.
등록된 댓글이 없습니다.
45. 원자분광법에서 사용하는 바탕보정 방법이 아닌 것은?
- ① Zeeman 바탕보정
- ② Doppler 바탕보정
- ③ 중수소 램프 바탕조정
- ④ 빛살 토막내기 바탕보정
등록된 댓글이 없습니다.
46. 다음 중 전도성 고체를 원자분광기에 도입하여 사용하기에 가장 적합한 방법은?
- ① 전열 증기화
- ② 레이저 증발
- ③ 초음파 분무법
- ④ 스파크 증발법
등록된 댓글이 없습니다.
47. X-선 파장이 고체 시료에서 원자 사이의 거리와 같은 정도이기 때문에 일어나는 현상과 이에 기반된 분광법이 옳게 짝지어진 것은?
- ① 방출, X-선 회절법
- ② 산란, X-선 회절법
- ③ 방출, X-선 형광 분광법
- ④ 산란, X-선 형광 분광법
등록된 댓글이 없습니다.
48. 어떤 시료의 흡광도(A)의 값이 0.397이라면 흡광도를 퍼센트 투광도로 나타낸 것은?
- ① 11.8
- ② 21.8
- ③ 31.8
- ④ 41.8
등록된 댓글이 없습니다.
49. 500m의 가시복사선의 광자 에너지는 약 몇 J인가? (단, Plank상수는 6.63×10-34Jㆍs, 빛의 속도는 3.00×108m/s이다.)
- ① 1.00×10-19
- ② 1.00×10-10
- ③ 4.00×10-19
- ④ 4.00×10-10
등록된 댓글이 없습니다.
50. 탄소-13 NMR스펙트럼에서 양성장 짝풀림(proton decoupling)을 위해 이용되지 않는 방법은?
- ① 펄스 짝풀림(pulsed decoupling)
- ② 넓은 띠 짝풀림(broadband decoupling)
- ③ 공명 없는 짝풀림(off-resonance decoupling)
- ④ 동핵 스핀 짝풀림(homonuclear spin decoupling)
등록된 댓글이 없습니다.
51. 원적외선 영역의 몇몇 광원에서 나오는 복사선의 세기는 아주 약하여 높은 회절차수들의 빛이 검출기에 들어오지 못하도록 사용되는 차수 분류필터에 의해서 더욱 약해진다. 이런 문제를 해결하기 위하여 사용된 기기를 무엇이라 하는가?
- ① Fourier 변환 분광계
- ② Plasma 분광계
- ③ 분자 형광 분광계
- ④ 분자 발광 분광계
등록된 댓글이 없습니다.
52. 분광법으로 흡광도를 측정할 때 나타나는 기기 잡음이 아닌 것은?
- ① 광원의 깜박이 잡음
- ② 광전 검출기의 산란 잡음
- ③ 열검출기의 Johnson 잡음
- ④ 단색화장치에서의 경로오차에 의한 잡음
등록된 댓글이 없습니다.
53. 원자흡수분광기에 가장 많이 사용하는 광원은?
- ① 레이저
- ② 텅스텐램프
- ③ 속빈음극관
- ④ D2램프
등록된 댓글이 없습니다.
54. C=0의 힘상수는 1×103N/m이고 C-O의 힘상수가 5×102N/m라고 하자. C=0의 신축진동이 1700cm-1 근처에서 나타난다면 C=0는 대략 어느 곳에서 나타나겠는가?
- ① 850cm-1
- ② 1200cm-1
- ③ 1700cm-1
- ④ 2400cm-1
등록된 댓글이 없습니다.
55. 신호대잡음비(signal-to-noise ratio)를 5배 증가시키기 위하여 몇 회 반복측정을 하여야 하는가?
- ① 5회
- ② 25회
- ③ 125회
- ④ 3125회
등록된 댓글이 없습니다.
56. 반사식 회절발 파장선택기의 분산능과 분해능에 대한 설명으로 틀린 것은?
- ① 회절발의 크기가 같을 때 분산능은 복사선의 파장에 무관하다.
- ② 회절발의 크기가 같을 때 선분산능의 클수록 분해능이 크다.
- ③ 회절발의 크기가 같을 때 각분산능이 클수록 분해능이 크다.
- ④ 회절발의 크기가 같을 때 홈 간 거리가 클수록 분해능이 크다.
등록된 댓글이 없습니다.
57. 물(H2O) 분자의 진동(Vibration) 방식(mode)과 적외선 흡수 스펙트럼에 대한 다음 설명 중 옳은 것은?
- ① 물의 진동 방식은 2가지이고 적외선 스펙트럼의 흡수대는 2개가 나타난다.
- ② 물의 진동 방식은 3가지이고 적외선 스펙트럼의 흡수대는 3개가 나타난다.
- ③ 물의 진동 방식은 3가지이고 적외선 스펙트럼의 흡수대는 2개가 나타난다.
- ④ 물의 진동 방식은 2가지이고 적외선 스펙트럼의 흡수대는 3개가 나타난다.
등록된 댓글이 없습니다.
58. NMR기기에서 자석은 자기장과 관련이 있으므로 중요한 부품이다. 감도와 분해능이 자석의 세기와 질에 따라서 달라지므로 자장의 세기를 정밀하게 조절하는 것이 중요하다. 다음 중 NMR기기에서 사용되는 초전도자석장치의 특징이 아닌 것은?
- ① 자기장의 균일하고 재현성이 높다.
- ② 초전도자석의 자기장이 일반 전자석보다 세다.
- ③ 전자석보다 복잡한 구조로 되어 있으므로 작동비가 많이 든다.
- ④ 초전도성을 유지하기 위해서 Nb/Sn이나 Nb/Ti 합금선으로 감은 솔레노이드를 사용한다.
등록된 댓글이 없습니다.
59. 형광(Fluorescence)에 대한 설명으로 가장 적절한 것은?
- ① σ*→σ 전이에서 주로 발생한다.
- ② pyridine, furan 등 간단한 헤테로 고리화합물은 접합고리구조를 갖는 화합물보다 형광을 더 잘 발생한다.
- ③ 전형적으로 형광은 수명이 약 10-10~10-5s 정도이다.
- ④ 250nm 이하의 자외선을 흡수하는 경우에 형광을 방출한다.
등록된 댓글이 없습니다.
60. IR을 흡수하려면 분자는 어떤 특성을 가지고 있어야 하는가?
- ① 분자구조가 사면체이면 된다.
- ② 공명구조를 가지고 있으면 된다.
- ③ 분자 내에 π결합이 있으면 된다.
- ④ 분자 내에서 쌍극자 모멘트의 변화가 있으면 된다.
등록된 댓글이 없습니다.
4과목 : 기기분석II
61. 각 원소의 동위원소 존재비가 아래의 표와 같다. 화합물 C10H6Br2의 (M+2)+/M+봉우리의 비에 가장 가까운 값은?

- ① 1.1
- ② 2.0
- ③ 2.6
- ④ 6.6
등록된 댓글이 없습니다.
62. 이온 사이클로트론 공명현상을 이용할 수 있게 설계되어 있는 질량분석기는?
- ① 사중극자 질량분석기
- ② 자기장 섹터 분석기
- ③ 비행-시간 질량분석기
- ④ Fourier 변환 질량분석기
등록된 댓글이 없습니다.
63. 액간 접촉전위(liquid junction potential)에 대한 설명으로 가장 거리가 먼 것은?
- ① 이온 간의 확산속도차이에 기인한다.
- ② 크기는 수 십 밀리볼트 정도이다.
- ③ 일반적으로 염화칼륨이 많이 쓰인다.
- ④ 두 용액 간에 염다리를 설치하면 완전제거가 가능하다.
등록된 댓글이 없습니다.
64. Var Deemter 도시로부터 얻을 수 있는 가장 유용한 정보는?
- ① 이동상의 적정한 유속(flow rete)
- ② 정지상의 적절한 온도(temperature)
- ③ 분석물질의 머무름 시간(retention time)
- ④ 선택 계수([α], selectivity coefficient)
등록된 댓글이 없습니다.
65. 0.1M Cu2+가 Cu(s)로 99.99% 환원되었을 때 필요한 환원전극 전위는 몇 V인가?

- ① 0.043
- ② 0.19
- ③ 0.25
- ④ 0.28
등록된 댓글이 없습니다.
66. 이온 선택성 막전극에서 막 또는 막의 매트릭스 속에 함유된 몇 가지 화학종들을 분석물 이온과 선택적으로 결합할 수 있어야 한다. 이 때 일반적인 결합의 유형이 아닌 것은?
- ① 이온교환
- ② 침전화
- ③ 결정화
- ④ 착물형성
등록된 댓글이 없습니다.
67. 액체 크로마토그래피 방법 중 가장 널리 이용되는 방법으로써 고체 지지체 표면에 액체 정지상 얇은 막을 형성하여 용질이 정지상 액체와 이동상 사이에서 나뉘어져 평형을 이루는 것을 이용한 크로마토그래피법은?
- ① 흡착 크로마토그래피
- ② 분배 크로마토그래피
- ③ 이온교환 크로마토그래피
- ④ 분자배제 크로마토그래피
등록된 댓글이 없습니다.
68. 벗김법(stripping method)이 다른 전압전류법보다 감도가 좋은 가장 큰 이유는?
- ① 매우 빠른 속도로 측정할 수 있으므로
- ② 전위를 변화시키면서 전류를 측정하므로
- ③ 전기분해과정을 통해 분석물이 농축되므로
- ④ 적하전극에서 일반적인 작용기들이 산화나 환원되기 때문에
등록된 댓글이 없습니다.
69. 질량 이동(mass transfer) 메카니즘 중 전지 내의 벌크 용액에서 질량이동이 일어나는 주된 과정으로서 정전기장 영향 아래에서 이온이 이동하는 과정을 무엇이라고 하는가?
- ① 확산(diffusion)
- ② 대류(convection)
- ③ 전도(conduction)
- ④ 전기 이동(migration)
등록된 댓글이 없습니다.
70. 크로마토그램에서 얻어진 봉우리를 주는 성분에 대한 기기의 감도인자를 알고 각 봉우리의 면적의 합에 대한 분석성분 봉우리의 면적 비로 함량을 분석하는 방법은?
- ① 표준물 첨가법(standard addition method)
- ② 내부 표준물법(internal standard method)
- ③ 면적 표준화법(area normalization method)
- ④ 표준물 검정곡선법(standard calibration curve method)
등록된 댓글이 없습니다.
71. 크로마토그래피에서 관의 성능을 비교하기 위해 도입된 관의 이론적 단수를 실험적으로 구하는데 필요한 것으로만 옳게 나열된 것은?

- ① ㉠, ㉡
- ② ㉠, ㉢
- ③ ㉠, ㉣
- ④ ㉡, ㉣
등록된 댓글이 없습니다.
72. 이온선택성 전극의 장점에 대한 설명 중 틀린 것은?
- ① 파괴성
- ② 짧은 감응시간
- ③ 직선적 감응의 넓은 범위
- ④ 색깔이나 혼탁도에 영향을 비교적 받지 않음
등록된 댓글이 없습니다.
73. 분자질량분석법에서 사용되는 이온화장치는 크게 기체-상이온화장치와 탈착식이온화장치(desorption source)로 나누어진다. 탈착 이온화장치에 적용되는 시료에 대한 설명으로 틀린 것은?
- ① 비휘발성 시료에 적용이 가능하다.
- ② 열에 불안정한 시료에 적용할 수 있다.
- ③ 액체 시료를 증발시키기 않고 직접 이온화시킨다.
- ④ 일반적으로 1000 이하의 분자량을 갖는 시료에 적용이 가능하다.
등록된 댓글이 없습니다.
74. 얇은 층 크로마토그래피에서 시료 전개 시점부터 전개 용매가 이동한 거리가 7cm, 용질 A가 이동한 거리가 4.5cm라면 자연인자(RF) 값은 얼마인가?
- ① 0.56
- ② 0.64
- ③ 2.5
- ④ 4.5
등록된 댓글이 없습니다.
75. 전압전류법에서 사용되는 미세전극은 크기가 작아서 생체세포나 혈액 등에 직접 사용할 수도 있으며, 앞으로도 많은 연구가 예상되는 전극이다. 미세전극의 장점에 대한 설명으로 가장 거리가 먼 것은?
- ① 전류의 면적이 작기 때문에 전류가 아주 작게 흐른다.
- ② 옴 손실이 적기 때문에 저항이 큰 용액이나 비수용매에 유용하다.
- ③ 빠른 전압의 주사로 수명이 짧은 화학종의 연구가 가능하다.
- ④ 일반적인 전극보다 페러데이 전류가 높아서 검출한계를 낮춘다.
등록된 댓글이 없습니다.
76. 중합체를 분석하는 시차주사 열량법(DSC)에 대한 설명으로 옳지 않은 것은?
- ① 시료와 기준물질 간의 온도 차이를 측정한다.
- ② 결정화 온도(Tc)는 발열 봉우리로 나타난다.
- ③ 유리전이 온도(Tg) 전후에는 열흐름(heat flow)의 변화가 생긴다.
- ④ 결정화 온도(Tc)는 유리전이 온도(Tg)와 녹는점 온도(Tm)사이에 위치한다.
등록된 댓글이 없습니다.
77. 기체크로마토그래피법에서 시료의 주입방법은 크게 분할주입과 비분할주입으로 나뉜다. 다음 중 분할주입(spilt injection)에 대한 설명이 아닌 것은?
- ① 열적으로 안정하다.
- ② 기체시료에 적합하다.
- ③ 고농도 분석물질에 적합하다.
- ④ 불순물이 많은 시료를 다룰 수 있다.
등록된 댓글이 없습니다.
78. 기체-액체 크로마토그래피(GLC)는 기체 크로마토그래피의 가장 흔한 형태로 이동상으로 기체를, 고정상으로는 액체를 사용하는 경우를 일컫는다. 이 때 이동상과 고정상 사이에서 분석물의 어떤 상호 작용이 분리에 기여하는가?
- ① 분배(Partition)
- ② 흡착(Adsorption)
- ③ 흡수(Absorption)
- ④ 이온교환(Ion Exchange)
등록된 댓글이 없습니다.
79. 질량분석기로 CH3CH2+(m=29.03858)와 HCO+(m=29.00218) 질량피크를 분리하려면 최소로 필요한 분해능은 약 얼마인가?
- ① 13.6
- ② 27.5
- ③ 800
- ④ 1.25×103
등록된 댓글이 없습니다.
80. 비극성 정지상의 GC에서 다음 3가지 물질, 즉 Propanol(끓는점=97℃), Butanol(끓는점=117℃), Pentanol(끓는점=138℃)을 분리했다. 다음 설명 중 옳은 것은?
- ① Propanol의 머무름 시간이 가장 짧다.
- ② Butanol의 머무름 시간이 가장 짧다.
- ③ Pentanol의 머무름 시간이 가장 짧다.
- ④ 머무름 시간은 3가지 물질 모두 동일하다.
등록된 댓글이 없습니다.