화학분석기사(구)(2014. 3. 2.) 시험일자 : 2014년 3월 2일
1과목 : 일반화학
1. 0.10M KNO3 용액에 관한 설명으로 옳은 것은?
- ① 이 용액 0.10L에는 6.0×1023개의 K+ 이온들이 존재한다.
- ② 이 용액 0.10L에는 1.0몰의 K+ 이온들이 존재한다.
- ③ 이 용액 0.10L에는 0.010몰의 K+ 이온들이 존재한다.
- ④ 이 용액 0.10L에는 6.0×1022개의 K+ 이온들이 존재한다.
등록된 댓글이 없습니다.
2. 다음 중 수소의 질량 백분율(%)이 가장 큰 것은?
- ① HCl
- ② H2O
- ③ H2SO4
- ④ H2S
등록된 댓글이 없습니다.
3. 다음 물질을 전해질의 세기가 강한 것부터 약해지는 순서로 나열한 것은?
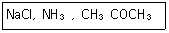
- ① NaCl>CH3COCH3>NH3
- ② NaCl>NH3>CH3COCH3
- ③ CH3COCH3>NH3>NaCl
- ④ CH3COCH3>NaCl>NH3
등록된 댓글이 없습니다.
4. 다음 중 산-염기 반응의 이 아닌 것은?
- ① C2H5OH+HCOOH
- ② CH3COOH+NaOH
- ③ CO2+NaOH
- ④ H2CO3+Ca(OH)2
등록된 댓글이 없습니다.
5. 다음 물질을 녹이고자 할 때, 물(H2O)과 사염화탄소(CCl4)중에서 물(H2)에 더욱 잘 녹을 것이라고 예상되는 물질을 모두 나타낸 것은?
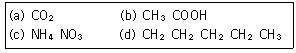
- ① (a), (b)
- ② (b), (c)
- ③ (a), (b), (c)
- ④ (b), (c), (d)
등록된 댓글이 없습니다.
6. 1.00g의 아세탈렌이 완전히 연소할 때 생성되는 이산화탄소의 부피는 표준상태에서 몇 L인가? (단, 모든 기체는 이상기체라 가정한다.)
- ① 1.225L
- ② 1.725L
- ③ 2.225L
- ④ 2.725L
등록된 댓글이 없습니다.
7. 산과 염기에 대한 설명 중 틀린 것은?
- ① 아레니우스 염기는 물에 녹으면 해리되어 수산화이온을 내놓는 물질이다.
- ② 아레니우스 산은 물에 녹으면 해리되어 수소이온을 내놓는 물질이다.
- ③ 염기는 리트머스의 색깔을 파란색에서 빨간색으로 변화시킨다.
- ④ 산은 마그네슘, 아연 등의 금속과 반응하여 수소기체를 발생시킨다.
등록된 댓글이 없습니다.
8. 이소프로필알코올(isopropyl alcohol)을 옳게 나타낸 것은?
- ① CH3-CH2-OH
- ② CH3-CH(OH)-CH3
- ③ CH3CH(OH)-CH2-CH3
- ④ CH3CH2-CH2-OH
등록된 댓글이 없습니다.
9. H2CO2O4에서 C의 산화수는?
- ① +1
- ② +2
- ③ +3
- ④ +4
등록된 댓글이 없습니다.
10. 수소연료전지에서 전기를 생산할 때의 반응식이 다음과 같을 때 10g의 H2와 160g의 O2가 반응하여 생성된 물은 몇 그램인가?
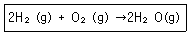
- ① 90g
- ② 100g
- ③ 110g
- ④ 120g
등록된 댓글이 없습니다.
11. 다음 두 반응의 평형상수 K같은 온도가 증가하면 어떻게 되는가?
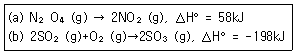
- ① (a), (b) 모두 증가
- ② (a), (b) 모두 감소
- ③ (a) 증가, (b) 감소
- ④ (a) 감소, (b) 증가
등록된 댓글이 없습니다.
12. 원자에 공통적으로 있는 입자이며 단위 음전하를 갖고 가장 가벼운 양성자 질량의 약 1/2000 정도로 매우 작은 질량을 갖는 것은?
- ① 원자
- ② 전자
- ③ 미립자
- ④ 중성자
등록된 댓글이 없습니다.
13. 0.3M의 황산용액 농도를 노르말 농도로 환산하면?
- ① 0.3N
- ② 0.6N
- ③ 0.9N
- ④ 1.2N
등록된 댓글이 없습니다.
14. 다음 중 비금속의 특징이 아닌 것은?
- ① 전기 전도성을 띄지 않는다.
- ② 공유결합을 통해 서로 결합할 수 있다.
- ③ 금속과 반응하여 음이온을 형성하려는 경향이 있다.
- ④ 주기율표의 왼쪽 윗부분에 배치되어 있다.
등록된 댓글이 없습니다.
15. 아스파탐(C14N18N2O2) 7.3g에 들어있는 질소 원자의 개수는 약 얼마인가?
- ① 3.0×1022
- ② 1.5×1022
- ③ 7.5×1021
- ④ 3.7×1021
등록된 댓글이 없습니다.
16. 다음 중에서 격자에너지(lattice energy)가 가장 작은 것은?
- ① LiF
- ② KF
- ③ Csl
- ④ NaBr
등록된 댓글이 없습니다.
17. 다음 원자나 이온 중 3개의 홀전자를 가지는 것은?
- ① N
- ② O
- ③ Al
- ④ S2-
등록된 댓글이 없습니다.
18. 다음 유기 화합물의 명칭 중 틀린 것은?
- ① CH2=CH2의 중합체는 폴리스티렌이다.
- ② CH2=CH-CN의 중합체는 폴리아크릴로니트릴이다.
- ③ CH2=CHOCOCH3의 중합체는 폴리아세트산비닐이다.
- ④ CH2=CHCl의 중합체는 폴리염화비닐이다.
등록된 댓글이 없습니다.
19. 다음 반응에서 평형 이동의 방향이 오른쪽이 아닌 것은?
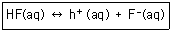
- ① [HF]의 증가
- ② [F-]
- ③ NaOH 첨가
- ④ NaF 첨가
등록된 댓글이 없습니다.
20. 기체에 대한 설명 중 틀린 것은?
- ① 동일한 온도 조건에서는 이상기체의 압력과 부피의 곱이 일정하게 유지되며 치를 Boyle의 법칙이라 한다.
- ② 기체 분자 운동론에 의해 기체의 절대온도는 기체 입자의 평균 운동 에너지의 척도로 나타낼 수 있다.
- ③ van der Waals는 보정된 압력과 보정된 부피를 이용하여 이상기체 방정식을 수정, 이상기체 법칙을 정확히 따르지 않는 실제 기체에 대한 방정식을 유도하였다.
- ④ 기체의 분출(effusion) 속도는 입자 질량의 제곱근을 정비례하여 미를 Graham의 확산법칙이라 한다.
등록된 댓글이 없습니다.
2과목 : 분석화학
21. Agl의 용해도곱은 8.3×10-17이다. 50.0mL의 0.1M I-를 0.050M Ag+-로 적정하였다. Ag+용액을 110.0mL 가했을 때 Ag+의 농도는?
- ① 0.050M
- ② 3.1×10-3M
- ③ 5.0×10-10M
- ④ 2.3×10-14M
등록된 댓글이 없습니다.
22. 다음 전기화학의 기본 개념과 관련한 설명 중 틀린 것은?
- ① 1주울의 에너지는 1암페어의 전류가 전위차가 1볼트인 점들 사이를 이동할 때 얻거나 잃는 양이다.
- ② 산화환원 반응(redox reaction)은 전자가 한 화학종에서 다른 화학종으로 옳아가는 것을 의미한다.
- ③ 전지 전압은 전기화학 반응에 대한 자유 에너지 변화에 비례한다.
- ④ 전류는 전기화학 반응의 반응속도에 비례한다.
등록된 댓글이 없습니다.
23. CaF2로 포화된 0.25M NaF 용액에서 이루어지는 화학븐응이 아닌 것은?
- ① NaF→Na++F-
- ② NaF+H2O→NaOH+HF
- ③ F-+H2O↔HF+OH-
- ④ CaF2↔Ca2+2F-
등록된 댓글이 없습니다.
24. 완충용액은(buffer solution)은 pH 변화를 억제하는 용액이다. 이 때 pH 변화를 얼마나 잘 막는지에 대한 척도로서 사용하는 완충용량(buffer capacity)에 대한 설명으로 맞는 것은?
- ① 완충용액 1.00을 pH 1단위만큼 변화시킬 수 있는 센 산이나 센 염기의 몰수
- ② 완충용액의 구성 성분이 약한 1.00L의 pH를 1단위만큼 변화시킬 수 있는 짝염기의 몰수
- ③ 완충용액 1.00L를 pH 1단위만큼 변화시킬 수 있는 약한 산 또는 그의 짝염기 몰수
- ④ 완충용액 중 짝염기에 대한 산의 농도비가 1이 되는데 필요한 약한 산의 몰수
등록된 댓글이 없습니다.
25. 성분이온 중 한 가지 이상이 용액 중에 들어있는 경우 그 염의 용해도가 감소하는 현상을 공통이온 효과라고 한다. 다음 중 공통이온 효과와 가장 관련이 있는 원리[법칙]는?
- ① 파울리(Pauli)의 배타원리
- ② 비어(Beer)의 법칙
- ③ 패러데이(Faraday) 법칙
- ④ 르 샤틀리에(Le Chatelier) 원리
등록된 댓글이 없습니다.
26. 다음 산화-환원 반응에 대한 설명 중 틀린 것은?
- ① 산화-환원 반응은 전자가 한 화학종에서 다른 화학종으로 이동하는 반응이다.
- ② 산화는 전자를 잃는 반응이다.
- ③ 환원제는 다른 화학종으로부터 전자를 받는다.
- ④ 산화-환원 반응에 관계된 전자를 전기회로를 통해 흐르게 하면 측정된 전압과 전류로부터 반응에 대한 정보를 얻을 수 있다.
등록된 댓글이 없습니다.
27. 0.100M CH3COOH 용액 50.0mL를 0.0500M NaOH로 적정 시 가장 적합한 지시약은?
- ① 메틸오렌지
- ② 페놀프탈레인
- ③ 브로모크레졸그린
- ④ 메틸레드
등록된 댓글이 없습니다.
28. 25℃에서 0.050M KCl 수용액의 H+의 활동도는 얼마인가? (단, H+와 OH-의 활동도 계수는 이온세기가 0.05M 일 때는 각각 0.86과 0.81이고, 이온세기가 0.10M 일 때는 각각 0.83과 0.76이다.)
- ① 1.03×10-7
- ② 1.05×10-7
- ③ 1.15×10-7
- ④ 1.20×10-7
풀이2023. 9. 6. 13:50삭제
https://ywpop.blogspot.com/2023/09/25-0050-m-kcl-h.html
29. 다음 화학평형식에 대한 설명으로 틀린 것은?
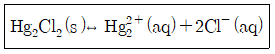
- ① 이 반응을 나타내는 평형상수는 KSP라고 하며 용해도상수 또는 용해도곱상수라고도 한다.
- ② 이 용액에 Cl-이온을 첨가하면 용해도는 감소한다.
- ③ 온도를 증가시키면 KSP는 변한다.
- ④ 이 용액에 Cl-이온을 첨가하면 KSP는 감소한다.
등록된 댓글이 없습니다.
30. 산화ㆍ환원 지시약에 대한 설명 중 틀린 것은? (단, E°는 표준환원전위, n은 전자수이다.)
- ① 분석하고자 하는 이온과 결합했을 때 산화된 상태와 환원된 상태의 색이 달라야 한다.
- ② 당량점에서의 전위와 지시약의 표준환원전위(E°)가 비슷한 것을 사용해야 한다.
- ③ 변색범위는 주로 이다.
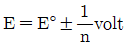
- ④ 지시약은 주로 이중 결합들이 콘주게이션(conjugated)된 유기물이다.
등록된 댓글이 없습니다.
31. 일정온도에서 1.0mol의 SO3을 1.0L 반응용기에 담았다. 반응이 평형에 도달하여 다음과 같은 평형을 유지할 때, SO2의 mol 수가 0.60mol로 측정되었다. 평형상수 값은 얼마인가?
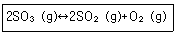
- ① 0.36
- ② 0.45
- ③ 0.54
- ④ 0.68
등록된 댓글이 없습니다.
32. 0.1M의 Fe2+ 50mL를 0.1M의 Tl3+로 적정한다. 반응식과 각각의 표준환원전위가 다음과 같을 때 당량점에서 전위(V)는 얼마인가?
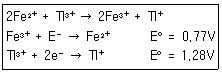
- ① 0.94
- ② 1.02
- ③ 1.11
- ④ 1.20
해설2022. 2. 26. 22:26삭제
https://ywpop.tistory.com/20561
33. 일반적으로 널리 사용되는 산화제인 MnO4-는 산성조건에서 (1)과 같은 환원 반쪽반응이을 하며 이때 Fe3+의 환원반쪽 반응은 (2)와 같다. 두 반응이 결합하여 산화-환원반응이 일어난다면 정확한 산화-환원반응식은?
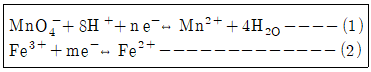
- ① MnO4-+Fe2++H+↔Mn2++Fe3+H2O
- ② MnO4-+3Fe2++4H+↔Mn2++3Fe3++2H2O
- ③ MnO4-+5Fe2++8H+↔Mn2++5Fe3++4H2O
- ④ MnO4-+5Fe2++8H+↔Mn2++5Fe2++4H2O
등록된 댓글이 없습니다.
34. 전지의 두 전극에서 반응이 자발적으로 진행되려는 경향을 갖고 있어 외부 도체를 통하여 산화전극에서 환원전극으로 전자가 흐르는 전지 즉, 자발적인 화학반응으로부터 전기를 발생시키는 전지를 무슨 전지라 하는가?
- ① 전해 전지
- ② 표준 전지
- ③ 자발 전지
- ④ 갈바니 전지
등록된 댓글이 없습니다.
35. 0.05M Fe2+ 100mL를 0.1M Ce4+로 적정하며, Pt전극과 Caloml 전극(SCE)을 이용하여 전위차를 측정하였다. 당량점에서의 두 전극의 전위차는?
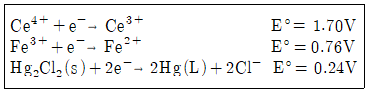
- ① 0.69V
- ② 0.99V
- ③ 1.23V
- ④ 1.47V
해설2022. 9. 15. 12:31삭제
https://ywpop.tistory.com/22250
36. 아세트산(CH3COOH)은 약한 산으로, 산해리상수(K3)값은 다음과 같은 평형식에서 구할 수 있다. CH3COOH↔CH3COO-+H+ K3값을 나타내는 화학편형식으로 옳은 것은?
- ①
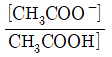
- ②
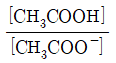
- ③
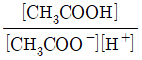
- ④
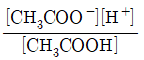
등록된 댓글이 없습니다.
37. 은이온은 트리에틸렌테트라아민과 안정한 1:1 착화합물을 형성한다. 0.01M 질산은 용액 20mL를 0.05M 트리에틸렌테트라아민 용액 10mL에 가했을 때, 평형상태에서 은이온농도는 얼마인가? (단, 착화합물 생성반응에 대한 형성상수(Kf)는 5.0×107이다.)
- ① 1.34×10-10
- ② 1.34×10-9
- ③ 1.34×10-8
- ④ 1.34×10-7
해설2022. 9. 15. 11:21삭제
https://ywpop.tistory.com/20560
38. EDTA 적정에 사용되는 xylenol orange와 같은 금속이온 지시약의 일반적인 특징이 아닌 것은?
- ① pH에 따라 색이 다소 변한다.
- ② 산화-환원제로서 전위(potential)에 따라 색이 다르다.
- ③ 지시약은 EDTA 보다 약하게 금속과 결합해야만 한다.
- ④ 금속이온과 결합하면 색깔이 변해야 한다.
등록된 댓글이 없습니다.
39. 0.05M 용액 50mL를 제조하는데 몇 g의 AgNO3가 필요한가? (단, AgNO2:169.9g/mol이다.)
- ① 0.425g
- ② 4.25g
- ③ 0.17g
- ④ 1.7g
등록된 댓글이 없습니다.
40. 다음 화학 반응의 E°값은 어떻게 표현되는가? Cd(s)+2Ag+↔Cd2++Ag(s) (단, 한쪽 반응식과 그에 따른 표준환원 전위(E°)는 다음과 같다.)
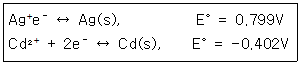
- ① 0.799-0.402
- ② 0.799+0.402
- ③ 0.799×2+0.402
- ④ 0.799×2-0.402
등록된 댓글이 없습니다.
3과목 : 기기분석I
41. 비불꽃 원자화 장치인 흑연로 원자화 분광 분석법의 장점이 아닌 것은?
- ① 분석비용이 싸고 분석시간이 짧다.
- ② 원자화 효율이 좋아 강도가 높다.
- ③ 제한된 적은 시료를 분석할 수 있다.
- ④ 유기물 시료를 전처리 과정 없이 분석할 수 있다.
등록된 댓글이 없습니다.
42. 분석기기 측정과정에서 정보를 전기적양으로 코드화하는 방식이 아닌 것은?
- ① 아날로그 영역
- ② 파수 영역
- ③ 티지털 영역
- ④ 시간 영역
등록된 댓글이 없습니다.
43. 모든 종류의 분석방법은 측정된 분석신호화 분석농도를 연관 짓는 과정으로 검정이 필요하다. 일반적으로 사용되는 방법과 이에 대한 설명을 연결한 것 중 잘못된 것은?
- ① 검정곡선-정확한 농도의 분석물을 포함하고 있는 몇 개의 표준용액을 넣고 검정곡선을 얻어 사용한다.
- ② 표준물 첨가법-매트릭스 효과가 있을 가능성이 상당히 있는 복잡한 시료분석에 특히 유용하다.
- ③ 내부표준물법-모든 시료, 바탕용액과 검정표준물에 일정량의 내부 표준물을 첨가하는 방식이다.
- ④ 표준물 첨가법-대부분 형태의 표준물 첨가법에서 시료 매트릭스는 각 표준물을 첨가한 후에 변화한다
등록된 댓글이 없습니다.
44. 250nm에서 A시료의 자외선 분광분석을 하고자 한다. 이 때 다음 용매 중 가장 부적합한 것은? (단, 모든 용매는 A에 대한 충분한 용해도를 갖고 있음)
- ① 물
- ② 메탄올
- ③ 벤젠
- ④ 에탄올
등록된 댓글이 없습니다.
45. 다음 중 선 광선(line sources)에 해당하는 것은?
- ① Nernst 백열등
- ② 니크롬 선
- ③ 글로바
- ④ 속빈 음극등
등록된 댓글이 없습니다.
46. 원자분광법에서 고체 시료를 원자화하기 위해 도입하는 방법은?
- ① 기체 분무기
- ② 글로우 방전
- ③ 초음파 분무기
- ④ 수소화물 생성법
등록된 댓글이 없습니다.
47. 다음 [보기]에서 설명하는 적외선 광원은?

- ① Nernst 백열등
- ② 텅스텐 필라멘트등
- ③ Globar 광원
- ④ 수은아크등
등록된 댓글이 없습니다.
48. 원자흡수분광법(AAS)에서 주로 사용되는 연료가스는 천연가스, 수소, 아세틸렌이다. 또한 산화제로서 공기, 산소, 산화이질소가 사용된다. 가장 높은 불꽃온도를 내는 연료가스와 산화제의 조합은?
- ① 천연가스-공기
- ② 수소-산소
- ③ 아세틸렌-산화이질소
- ④ 아세틸렌-산소
등록된 댓글이 없습니다.
49. FT-IR 기기와 관련 없는 장치는?
- ① 광원장치
- ② 단색화장치
- ③ 빛살분할기
- ④ 갑섭계
등록된 댓글이 없습니다.
50. 분산형기기와 비교한 푸리에변환 분광법의 장점에 대한 설명이 아닌 것은?
- ① 주어진 분리능에서 신호대 잡음비를 개선시킨다.
- ② 전체 간섭도를 빠른 시간 내에 기록하고 저장할 수 있다.
- ③ 투광도의 측정 시 정확도가 아주 높다.
- ④ 거의 일정한 스펙트럼을 얻을 수 있다.
등록된 댓글이 없습니다.
51. 나트륨은 589.0nm와 589.6nm에서 강한 스펙트럼(선)을 나타낸다. 두 선을 구분하기 위해 필요한 분해능은?
- ① 0.6
- ② 491.2
- ③ 589.3
- ④ 982.2
등록된 댓글이 없습니다.
52. 형광과 인광에 영향을 주는 변수로서 가장 거리가 먼 것은?
- ① pH
- ② 온도
- ③ 압력
- ④ 분자구조
등록된 댓글이 없습니다.
53. 적외선(IR) 흡수분광법에서의 진동 짝지음에 대한 설명으로 틀린 것은?
- ① 두 신축진동에서 두 원자가 각각 단독으로 존재할 때 신축진동사이엔 센 짝지음이 일어난다.
- ② 짝지음 진동들이 각각 대략 같은 에너지를 가질 때 상호작용은 거의 일어나지 않는다.
- ③ 두 개 이상의 결합에 의해 떨어져 진동할 때 상호작용은 거의 일어나지 않는다.
- ④ 짝지음은 같은 대칭성 화학종에서 진동할 때 일어난다.
등록된 댓글이 없습니다.
54. 다음 그림은 무엇을 측정하기 위한 장치의 개요도인가?
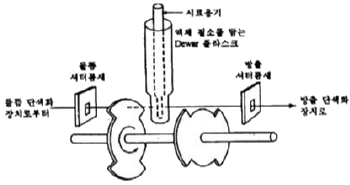
- ① 형광
- ② 화학발광
- ③ 인광
- ④ 라만 산란광
등록된 댓글이 없습니다.
55. n→π 전이의 경우 흡수 봉우리는 용매의 극성 증가에 따라 파장이 어느 쪽으로 하는지와 이동의 명칭을 옳게 나타낸 것은?
- ① 짧은 파장 쪽, 적색 이동
- ② 짧은 파장 쪽, 청색 이동
- ③ 긴 파장 쪽, 적색 이동
- ④ 긴 파장 쪽, 청색 이동
등록된 댓글이 없습니다.
56. 에틸알코올(C2H6O)의 1H-핵자기공명 스펙트럼에 대한 설명으로 틀린 것은?
- ① 화학적 이동에 의하여 세 곳에서 양성자 봉우리가 나타난다.
- ② 고분해능 NMR로 분석시 TMS 기준점에서 가장 가까이 나타나는 소수의 봉우리는 넷으로 갈라진다.
- ③ 알코올의 OH 수소원자를 중수소로 치환하면 스펙트럼에서 OH에 해당되는 봉우리가 사라진다.
- ④ 300MHz 분석 장비를 사용하면 60MHz 분석장비를 사용하였을 때보다 더 명확히 스핀-스핀 칼라짐을 관찰할 수 있다.
등록된 댓글이 없습니다.
57. 자외선 분광법에서 흡수 봉우리의 차장이 가장 짧을 것으로 예측되는 분자는?
- ① 1.3-butadiene
- ② 1.4-pentadiene
- ③ 1.3.5-hexatriene
- ④ 1.3.5.7-octatetraene
등록된 댓글이 없습니다.
58. 텅스텐관구와 LiF 분광결정(d=2.01Å)을 썼을 때 어떤 순금속의 예민한 X-선 스펙트럼이 2θ=69.36°에서 관측되었다. 형광 X-선의 파장은?
- ① 1.978Å
- ② 2.153Å
- ③ 2.287Å
- ④ 3.762Å
등록된 댓글이 없습니다.
59. 초점거리(F)가 0.50m인 단색화장치(monochromator)안에 1mm당 2000개의 홈(blase)이 새겨진 회절발(echellettegrating)이 설치되어 있다. 이 단색화장치의 1차(first-order) 스펙트럼에 대한 역선분산능(reciprocal linear dispersion:D-1)의 값은?
- ① 1.0nm/mm
- ② 100nm/mm
- ③ 1.0×103nm/mm
- ④ 1.0×106nm/mm
등록된 댓글이 없습니다.
60. 기기분석법에서 신호-대-잡음비를 개선하기 위하여 하드웨어와 소프트웨어 방법을 이용할 수 있는데 잡음을 줄이는 하드웨어 장치로 이용되는 방법이 아닌 것은?
- ① Fourier 변환기
- ② 아날로그 필터
- ③ 변조기
- ④ 동시화복조기
등록된 댓글이 없습니다.
4과목 : 기기분석II
61. 카드뮴전극이 1.0M Cd2+(반쪽전위 E°=-0.40V)용액에 담겨진 반쪽전위의 전위는 얼마인가?
- ① -0.2V
- ② -0.4V
- ③ -2.0V
- ④ -4.0V
등록된 댓글이 없습니다.
62. 질량분석스펙트럼에서 동위원소 봉우리가 가장 큰 것은?
- ① 에탄
- ② 에탄올
- ③ 아세톤
- ④ 염화에틸
등록된 댓글이 없습니다.
63. 길어야 30cm인 크로마토그래피의 분리관에 의하여 혼합물 시료로부터 성분 A를 분리하였다. 분리된 성분 A의 머무름 시간은 12분 이었으며, 분리된 봉우리 밑변의 나비가 2.4분 이었다면 단 높이는 얼마인가?
- ① 7.5×10-2cm
- ② 14×10-2cm
- ③ 2.5cm
- ④ 12.5cm
등록된 댓글이 없습니다.
64. 유리전극에 대한 설명으로 틀린 것은?
- ① 이온 선택성 전극의 한 종류이다.
- ② 수소이온에 선택적으로 감응하는 특성이 있다.
- ③ 복합전극은 두 개의 기준전극이 필요하다.
- ④ 선택계수가 클수록 성능이 우수한 전극이다.
등록된 댓글이 없습니다.
65. 역상 액체크로마토그래피에서 가장 먼저 용리되어 나오는 성분은?
- ① 벤젠
- ② n-헥산올
- ③ 톨루엔
- ④ n-헥산
등록된 댓글이 없습니다.
66. 질량분석기에서 사용되는 시료도입장치가 아닌 것은?
- ① 직접 도입장치
- ② 배치식 도입장치
- ③ 펠렛식 도입장치
- ④ 크로마토그래피 도입장치
등록된 댓글이 없습니다.
67. 가스 크로마토그래피의 전개 가스의 유속이 20mL/min이고 기록지의 속도가 5cm/min이고 봉우리 꼭지점까지의 길이가 30cm일 때 머무름 부피는?
- ① 100mL
- ② 120mL
- ③ 140mL
- ④ 160mL
등록된 댓글이 없습니다.
68. 기체크로마토그래피와 검출기 중 불꽃이온화검출기(FID)가. 가장 유용하게 사용될 수 있는 경우는?
- ① 자연수 중의 유기물질 오염도 측정 시
- ② 유기농 채소 속의 물의 함량 측정 시
- ③ 공기 중 이산화탄소의 함량 측정 시
- ④ 자동차 배기가스 중 SO2의 함량 측정 시
등록된 댓글이 없습니다.
69. 전도도법을 이용하여 염산을 수산화나트륨으로 적정하고자 한다. 전도도의 변화를 적정곡선으로 바르게 나타낸 것은?
- ① 전도도는 감소하다가 종말점 이후에는 증가한다.
- ② 전도도는 증가하다가 종말좀 이후에는 감소한다.
- ③ 전도도는 감소하다가 종말점 이후에는 일정하게 유지된다.
- ④ 전도도는 증가하다가 종말점 이후에는 일정하게 유지된다.
등록된 댓글이 없습니다.
70. 전압전류법의 일종인 플라로그래피법에 사용하는 적하수은전극의 장점이 아닌 것은?
- ① 수소의 환원에 대한 과전압이 크다.
- ② 새로운 수은전극표면이 계속 생긴다.
- ③ 재현성 있는 평균전류를 얻을 수 있다.
- ④ 수은이 쉽게 산화되지 않아서 효과적이다.
등록된 댓글이 없습니다.
71. 분자량 10,000 이상의 생체 고분자를 분리하기 위한 가장 적합한 방법은?
- ① 흡착크로마토그래피
- ② 베제크로마토그래피
- ③ 분배크로마토그래피
- ④ 이온교환크로마토그래피
등록된 댓글이 없습니다.
72. 질량분석법에서 순수한 시료가 시료도입장치를 통해 이온화실로 도입되어 이온화된다. 분자를 기체상태 이온으로 만들 때 사용하는 장치가 아닌 것은?
- ① 전자충격장치(electron impact source:EI)
- ② 화학적 이온화장치(chemical ionization source:Cl)
- ③ 장탈착장치(field desorption:FD)
- ④ 이중초점 분석기(couble focusing)
등록된 댓글이 없습니다.
73. 기체-고체 크로마토그래피(GSC)에 대한 설명으로 틀린 것은?
- ① 고페표면에 기체물질이 흡착되는 현상을 이용한다.
- ② 분포상수는 보통 GLC의 경우보다 적다.
- ③ 기체-액체 컬럼에 머물지 않는 화학종을 분리하는데 유용하다.
- ④ 충전 컬럼과 열린관 컬럼 두 가지 모두 사용된다.
등록된 댓글이 없습니다.
74. 전압전류법으로 수용액 중의 무기물질을 정량하고자 할 때, 용존산소를 제거할 필요가 있다. 다음 중 적합한 방법은?
- ① 시료용액의 온도를 높인다.
- ② 불활성기체를 시료용액 속으로 불어 넣는다.
- ③ 시료용액의 pH를 낮게 유지된다.
- ④ 시료용액을 강하게 저어준다.
등록된 댓글이 없습니다.
75. 이동상이 액체인 크로마토그래피가 아닌 것은?
- ① 분배 크로마토그래피
- ② 액체-고체 크로마토그래피
- ③ 이온교환 크로마토그래피
- ④ 확산 크로마토그래피
등록된 댓글이 없습니다.
76. 시차주사열량법에서 중합체를 측정할 때의 열량변화와 관련이 없는 것은?
- ① 결정화
- ② 산화
- ③ 승화
- ④ 용융
등록된 댓글이 없습니다.
77. HPLC의 검출기에 대한 설명으로 옳은 것은?
- ① UV 흡수 검출기는 254nm의 파장만을 사용한다.
- ② 굴절율 검출기는 대부분의 용질에 대해 감응하나 온도에 매우 민감하다.
- ③ 형광검출기는 대부분의 화학종에 대해 사용이 가능하나 감도가 낮다.
- ④ 모든 HPLC 검출기는 용액의 물리적 변화만을 감응한다.
등록된 댓글이 없습니다.
78. 전자충격이온화법(EO)에서 가장 일반적으로 사용하고 있으며 얻어진 스펙트럼에 대해서 상업화된 library search가 가능한 이온화에너지 값은 얼마인가?
- ① 10eV
- ② 30eV
- ③ 70eV
- ④ 120eV
등록된 댓글이 없습니다.
79. 가스크로마토그래피에서 비누거품 유속계를 이용하여 유속을 측정하는 방법을 옳게 설명한 것은?
- ① 비누거품 유속계를 유속제어기 바로 뒤에 연결하여 유속을 측정한다.
- ② 비누거품 유속계를 시료주입기 바로 앞에 연결하여 유속을 측정한다.
- ③ 비누거품 유속계를 관 바로 앞에 연결하여 유속을 측정한다.
- ④ 비누거품 유속계를 관 바로 뒤에 연결하여 유속을 측정한다.
등록된 댓글이 없습니다.
80. 분자질량분석법에 사용되는 이온원의 종류 중 가장 큰 에너지의 전자를 이용하는 방법은?
- ① 전자 충격법
- ② 전기분무 이온화법
- ③ 빠른 원자 충격법
- ④ 열분무 이온화법
등록된 댓글이 없습니다.