화학분석기사(구)(2010. 9. 5.) 시험일자 : 2010년 9월 5일
1과목 : 일반화학
1. 한 수저는 금으로 도금하고, 다른 수저는 구리로 도금하고자 한다. 만약 발전기에서 나오는 일정한 전류를 두 수저를 도금하는데 사용하였다면, 어느 수저에 먼저 1g이 도금되고 그 이유는 무엇인가? (단, 금의 원자량은 197, 구리의 원자량은 63.5이며, 반쪽 환원 반응식은 다음과 같다.)
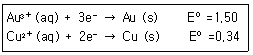
- ① 금 수저-금의 분자량이 더 크기 때문이다.
- ② 금 수저-금이 더 많은 전자로 환원되기 때문이다.
- ③ 구리수저-구리가 기전력이 더 낮기 때문이다.
- ④ 구리수저-구리가 더 적은 전자로 환원되기 때문이다.
등록된 댓글이 없습니다.
2. 질량백분율 10.0% NaCl 수용액의 몰랄농도는 얼마인가? (단, NaCl의 물질량은 58.44g/mol 이다.)
- ① 0.171m
- ② 1.71m
- ③ 0.19m
- ④ 1.9m
등록된 댓글이 없습니다.
3. KNO3 1.345g을 녹여 25.00mL 수용액을 만들었다. 이 용액의 몰 농도는? (단, K의 원자량은 39이다.)
- ① 1.1345M
- ② 1.3450M
- ③ 0.2690M
- ④ 0.5327M
등록된 댓글이 없습니다.
4. 어떤 물질의 화학식이 C2H2ClBr로 주어졌고, 그 구조가 다음과 같을 때에 대한 설명으로 틀린 것은?
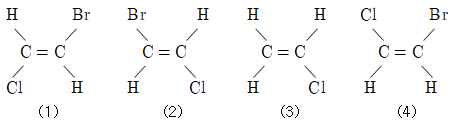
- ① (1)과 (2)는 동일 구조이다.
- ② (2)과 (4)는 동일 구조이다.
- ③ (2)과 (3)는 기하 이성질체 관계이다.
- ④ (3)과 (4)는 동일 구조이다.
등록된 댓글이 없습니다.
5. HCIO의 명칭은 무엇인가?
- ① 염소산
- ② 과염소산
- ③ 아염소산
- ④ 하이포아염소산
등록된 댓글이 없습니다.
6. 다원자 이온에 대한 명명 중 옳지 않은 것은?
- ① CH3COO-:아세트산이온
- ② NO3-:질산이온
- ③ SO32-:황산이온
- ④ HCO3-:탄산수소이온
등록된 댓글이 없습니다.
7. 고리구조를 갖지 않는 어떤 화합물의 화학식이 C4H8일 경우 이 물질이 갖는 이성질체수는 모두 몇 개인가?
- ① 2개
- ② 3개
- ③ 4개
- ④ 5개
등록된 댓글이 없습니다.
8. 주기율표에서의 일반적인 경향으로 옳은 것은?
- ① 원자 반지름은 같은 족에서는 위로 올라갈수록 증가한다.
- ② 원자 반지름은 같은 주기에서는 오른쪽으로 갈수록 감소한다.
- ③ 같은 주기에서는 오른쪽으로 갈수록 금속성을 증가한다.
- ④ 0족에서는 금속성 물질만 존재한다.
등록된 댓글이 없습니다.
9. 철은 철광석으로부터 다음 반응에 의해 형성된다고 할 때 Fe(s) 1mol을 형성하기 위해 필요한 O2(g)의 mol수는?
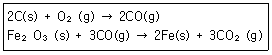
- ① 0.5
- ② 0.75
- ③ 1
- ④ 1.5
등록된 댓글이 없습니다.
10. 밑줄 친 원자의 산화수를 잘못 나타낸 것은?
- ①
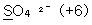
- ②
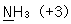
- ③
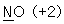
- ④
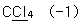
등록된 댓글이 없습니다.
11. 배의 철 표면이 녹스는 것을 방지하기 위하여 종종 마그네슘 판을 붙인다. 이 작업을 하는 이유는?
- ① 마그네슘이 철보다 더 좋은 산화제이므로 마그네슘이 더 산화되기 쉽다.
- ② 마그네슘이 철보다 더 좋은 산화제이므로 마그네슘이 더 환원되기 쉽다.
- ③ 마그네슘이 철보다 더 좋은 환원제이므로 마그네슘이 더 산화되기 쉽다.
- ④ 마그네슘이 철보다 더 좋은 환원제이므로 마그네슘이 더 환원되기 쉽다.
등록된 댓글이 없습니다.
12. 물질을 수용액에 녹였을 때의 성질이 틀린 것은?
- ① CO2-산성
- ② Na2O-염기성
- ③ Na2CO3-산성
- ④ N2O5-산성
등록된 댓글이 없습니다.
13. 다음은 계수를 맞추지 않은 C5H12의 연소 반응식이다. C5H12 1몰을 연소하기 위해서는 산소가 몇 몰 필요한가?
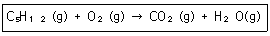
- ① 2
- ② 5
- ③ 6
- ④ 8
등록된 댓글이 없습니다.
14. 어떤 반응의 평형상수를 알아도 예측할 수 없는 것은?
- ① 평형에 도달하는 시간
- ② 어떤 농도가 평형조건을 나타내는지 여부
- ③ 주어진 초기농도로부터 도달할 수 있는 평형의 위치
- ④ 반응의 진행 정도
등록된 댓글이 없습니다.
15. 돌턴(Dalton)의 원자설에서 설명한 내용이 아닌 것은?
- ① 물질은 더 이상 나눌 수 없는 원자로 이루어져 있다.
- ② 원자가전자의 수는 화학결합에서 중요한 역할을 한다.
- ③ 같은 원소의 원자들은 질량이 동일하다.
- ④ 서로 다른 원소의 원자들이 간단한 정수비로 결합하여 화합물을 만든다.
등록된 댓글이 없습니다.
16. 수소이온 농도 0.0001M의 pH는?
- ① 3
- ② 4
- ③ 5
- ④ 6
등록된 댓글이 없습니다.
17. 메탄 2.80g에 들어있는 메탄 분자수는 얼마인가?
- ① 0.98×1022 분자
- ② 1.05×1023 분자
- ③ 1.93×1022 분자
- ④ 1.93×1023 분자
등록된 댓글이 없습니다.
18. 전자들이 바닥상태에 있다고 가정할 때 질소원자에 대한 전자배치로 옳은 것은?
- ① 1s22s12p1
- ② 1s22s22p6
- ③ 1s22s22p3
- ④ 1s22s23p3
등록된 댓글이 없습니다.
19. 벤젠을 실험식으로 옳게 나타낸 것은?
- ① C6H6
- ② C6H5
- ③ C5H6
- ④ CH
등록된 댓글이 없습니다.
20. 다음 중 극성 분자가 아닌 것은?
- ① OCl4
- ② H2O
- ③ CH3OH
- ④ HCl
등록된 댓글이 없습니다.
2과목 : 분석화학
21. 다음 전기화학에 관한 설명으로 옳은 것은?
- ① 전자를 잃었을 때 산화되었다고 하며, 산화제는 전자를 잃고 자신이 산화된다.
- ② 전자를 얻게 되었을 때 산화되었다고 하며, 환원제는 전자를 얻고 자신이 산화된다.
- ③ 볼트(V)의 크기는 쿨롱(C)당 주울(J)의 양이다.
- ④ 갈바니 전지(galvanic cell)는 자발적인 화학반응으로부터 전기를 발생시키는 영구기관이다.
등록된 댓글이 없습니다.
22. EDTA 적정에 사용되는 xylenol orange와 같은 금속이온 지시약의 일반적인 특징이 아닌 것은?
- ① pH에 따라 고유한 색을 나타낸다.
- ② 산화-환원제로서 전위(potential)에 따라 색이 다르다.
- ③ 지시약은 EDTA보다 약하게 금속과 결합해야만 한다.
- ④ 금속이온과 결합하면 색깔이 변해야 한다.
등록된 댓글이 없습니다.
23. 0.1M 약염기 B(Kb=2.6×10-6) 100mL 수용액에 0.1M HNO3 50mL 수용액을 가했을 때의 pH는? (단, Kb는 염기해리상수이고 물의 해리상수는 1.0×10-14이다.)
- ① 5.74
- ② 7.00
- ③ 8.41
- ④ 9.18
등록된 댓글이 없습니다.
24. 다음 수용액들의 농도는 모두 0.1M이다. 이온세기(ionic strength)가 가장 큰 것은?
- ① NaCl
- ② Na2SO4
- ③ Al(NO3)3
- ④ MgSO4
등록된 댓글이 없습니다.
25. EDTA 적정에 일반적으로 사용되는 금속이온 지시약으로만 되어 있는 것은?
- ① 페놀프탈레인, 메틸오렌지
- ② 페놀프탈레인, EBT(Eriochrome Black T)
- ③ EBT(Eriochrome Black T), 크실레놀오렌지(Xylenol orange)
- ④ 크실레놀오렌지(Xylenol orange), 메틸오렌지
등록된 댓글이 없습니다.
26. 산염기 적정을 할 때 사용하는 지시약에 대한 설명으로 틀린 것은?
- ① 적정의 종말점을 검출하기 위하여 색변화가 있는 지시약을 사용한다.
- ② 명확한 색변화를 위하여 가능한 많은 양의 지시약을 첨가한다.
- ③ 관찰되는 종말점과 참 당량점의 차이를 지시약 오차라고 한다.
- ④ 메틸 레드, 페놀 레드도 지시약으로 사용될 수 있다.
등록된 댓글이 없습니다.
27. 약산인 HF(Ka=6.8×10-4)와 약산인 CH3COOH(Ka=1.8×10-5)에 대한 다음 반응식의 평형상수 값은 약 얼마인가?
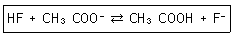
- ① 1.2×10-8
- ② 2.6×102
- ③ 3.8×10
- ④ 6.6×10-4
등록된 댓글이 없습니다.
28. Fe2+이온을 Ce4+로 적정하는 반응에 대한 설명 중 잘못된 것은?
- ① 적정반응은 Ce4++Fe2+→Ce3++Fe3+ 이다.
- ② 전위차법을 이용한 적정에서는 반당량점에서의 전위는 당량점의 전위(Ve)의 약 1/2이다.
- ③ 당량점에서 [Ce3+]=[Fe3+], [Fe2+]=[Ce4+]이다.
- ④ 당량점부근에서 측정된 전위의 변화는 미세하여 정확한 측정을 위해 산화-환원 지시약을 사용해야 한다.
등록된 댓글이 없습니다.
29. 할로겐 음이온을 0.050M Ag+ 수용액으로 적정하였다. AgCl, AgBr, AgI의 용해도곱은 각각 1.8×10-18, 5.0×10-13, 8.3×10-17이다. 당량점이 가장 뚜렷하게 나타나는 경우는?
- ① 0.05M Cl-
- ② 0.10M Cl-
- ③ 0.10M Br
- ④ 0.10M I-
등록된 댓글이 없습니다.
30. 질소와 수소로부터 암모니아를 만드는 반응에서 평형을 이동시켜 암모니아의 수득률을 높이는 방법이 아닌 것은?
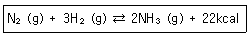
- ① 질소의 농도를 증가시킨다.
- ② 압력을 높인다.
- ③ 암모니아의 농도를 증가시킨다.
- ④ 수소의 농도를 증가시킨다.
등록된 댓글이 없습니다.
31. 표준 수소 전극에서의 반응 및 표준 전위(E°)를 가장 옳게 나타낸 것은? (단, A는 각 성분의 활동도이다.)
- ① 2H+(A=1)+2e-⇄H2(A=2) E°=0.0V
- ② 2H+(A=2)+2e-⇄H2(A=1) E°=1.0V
- ③ 2H+(A=1)+2e-⇄H2(A=1) E°=0.0V
- ④ 2H+(A=2)+2e-⇄H2(A=2) E°=1.0V
등록된 댓글이 없습니다.
32. EDTA에 대한 일반적인 설명 중 틀린 것은?
- ① 음이온과 강하게 결합하여 착물을 형성한다.
- ② 여섯 개의 리간드 자리를 가지고 있다.
- ③ 4개의 카르복실 작용기를 포함하고 있다.
- ④ pH 조절을 통해 금속이온의 선택성을 높일 수도 있다.
등록된 댓글이 없습니다.
33. 특정 화학종이 녹아 있는 수용액의 전위차를 측정하기 위하여 두개의 백금전극이 다음 그림과 같이 담겨 있다. 그림을 가장 옳게 표시한 것은?
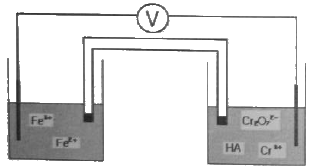
- ① Pt(s), Fe2+, Fe2+(aq), Fe3+(aq):Cr2O72-(aq), Cr3+(aq), HA(aq), Pt(s)
- ② Pt(s):Fe2+(aq), Fe3+(aq) | Cr2O72-(aq), Cr3+(aq), HA(aq):Pt(s)
- ③ Pt(s) | Fe2+(aq), Fe3+(aq)║Cr2O72-(aq), Cr3+(aq), HA(aq) | Pt(s)
- ④ Pt(s)║Fe2+(aq), Fe3+(aq) | Cr2O72-(aq), Cr3+(aq), HA(aq)║Pt(s)
등록된 댓글이 없습니다.
34. MnO4- 이온에서 망간(Mn)의 산화수는 얼마인가?
- ① -1
- ② +4
- ③ +6
- ④ +7
등록된 댓글이 없습니다.
35. CaF2의 용해와 관련된 반응식에서 과량의 고체 CaF2가 남아 있는 포화된 수용액에서 Caa2+(aq)의 몰 농도에 대한 설명으로 옳은 것은? (단, 용해도의 단위는 mol/L이다.)
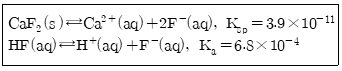
- ① KF를 첨가하면 몰 농도가 감소한다.
- ② HCl을 첨가하면 몰 농도가 감소한다.
- ③ KCl을 첨가하면 몰 농도가 감소한다.
- ④ H2O를 첨가하면 몰 농도가 증가한다.
등록된 댓글이 없습니다.
36. 갈바니 전지(galcanic cell)의 염다리에 관한 설명 중 틀린 것은?
- ① 염다리는 KCl, KNO3, NH4Cl과 같은 염으로 채워져 있다.
- ② 염다리를 통하여 갈바니 전지는 전체적으로 전기적 중성이 유지된다.
- ③ 염다리의 염용액 농도는 매우 낮다.
- ④ 염다리에는 다공성 마개가 있어 서로 다른 두 용액이 서로 섞이는 것을 방지한다.
등록된 댓글이 없습니다.
37. 메틸아민(Methylamine)은 약한 염기로, 염해리상수(Kb)값은 다음과 같은 평형식에서 구할 수 있다. 메틸아민의 짝산인 메틸암모니움 이온(Methylammonium ion)의 산해리상수(Ka)를 구하기 위한 화학평형식으로 옳은 것은?
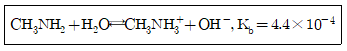
- ① CH3NH2⇄CH3N-H+H+
- ② CH3NH3++OH-⇄CH3NH2+H2O
- ③ CH3NH2+OH-⇄CH3N-H+H2O
- ④ CH3NH3+⇄CH3NH2+H+
등록된 댓글이 없습니다.
38. 적정(titration)에 쓰이는 용어에 관한 설명으로 틀린 것은?
- ① 당량점(equivalence point)-적정 시약의 양이 분석물질과 화학량론적으로 반응하는데 꼭 필요한 만큼 가해졌을 때 일어난다.
- ② 종말점(end point)-용액의 물리적 성질이 갑자기 변하는 점이다.
- ③ 지시약(indicator)-적정이 완결되는 부근에서 물리적 특성이 갑자기 변하는 화합물이다.
- ④ 직접 적정(direct titration)-분석물질에 농도를 알고 있는 첫 번째 표준시약을 과량 가한 다음 두 번째 표준시약을 사용하여 과량의 첫 번째 표준시약을 적정하는 방법이다.
등록된 댓글이 없습니다.
39. 금속착화합물(metal complex)에서 금속이온과 리간드간의 결합형태는 무엇인가?
- ① 금속결합
- ② 이온결합
- ③ 수소결합
- ④ 배위결합
등록된 댓글이 없습니다.
40. 이양성자산(H2A)의 pKa1이 4.0이고, pKa2는 8.0이다. 1.0M의 이양성자산(H2A)의 pH는?
- ① 1.0
- ② 2.0
- ③ 4.0
- ④ 6.0
등록된 댓글이 없습니다.
3과목 : 기기분석I
41. 원자흡수분광법과 원자형광분광법에서 기기의 부분 장치 배열에서의 큰 차이점은 무엇인가?
- ① 원자흡수분광법은 광원 다음에 사료잡이가 나오고 원자형광분광법은 그 반대이다.
- ② 원자흡수분광법은 파장선택기가 광원보다 먼저 나오고 원자형광분광법은 그 반대이다.
- ③ 원자흡수분광법에서는 광원과 시료잡이가 일직선상에 있지만 원자형광분광법에서는 광원과 시료잡이가 직각을 이룬다.
- ④ 원자형광분광법은 레이저 광원을 사용할 수 없으나 원자형광분광법에서는 사용 가능하다.
등록된 댓글이 없습니다.
42. 다음의 분자 흡수 특성 중 발색단과 전이형태 관계가 잘못된 것은?
- ① Alkene:π→π*
- ② Amido:π→σ*
- ③ Carboxyl:n→π*
- ④ Azo:n→π*
등록된 댓글이 없습니다.
43. 분자의 들뜬 상태(excited state)에 대한 설명으로 틀린 것은?
- ① 적외선이 분자의 진동을 유발한 상태
- ② X-선이 분자를 이온화시킨 상태
- ③ 분자가 마이크로파의 복사선을 흡수한 상태
- ④ 분자가 광자를 방출하여 주변의 에너지 준위가 높아진 상태
등록된 댓글이 없습니다.
44. 순수한 화합물 A를 녹여 정확히 10mL의 용액을 만들었다. 이 용액 중 1mL를 분취하여 100mL로 묽힌 후 250nm에서 0.50cm의 셀로 측정한 흡광도가 0.432이었다면 처음 10mL 중에 있는 시료의 몰농도는? (단, A의 물 흡광계수 ε=4.32×10-3M-1cm-1이다.)
- ① 1×10-2M
- ② 2×10-2M
- ③ 1×10-3M
- ④ 2×10-4M
등록된 댓글이 없습니다.
45. 전열원자화 장치에 대한 설명으로 틀린 것은?
- ① 전열원자화 장치의 가열순서는 건조, 원자화, 회화단계 순서이다.
- ② 전열원자화 장치는 작업부, 전력부, 비활성기체 공급조절부로 구성된다.
- ③ 전열원자화 장치의 로(Furnace) 주변은 물로 냉각하여 온도를 유지한다.
- ④ 고온에서 흑연의 산화방지를 위해 비활성기체(아르곤)분위기에서 측정한다.
등록된 댓글이 없습니다.
46. X-선 회절기기에서 토파즈(격자간격 d=1.356Å)가 회절결정으로 사용되는 경우 Ag의 Ka1 선인 0.497Å을 관찰하기 위해서는 측각기(goniometer) 각도를 몇 도에 맞추어야 하는가? (단, 2θ값을 계산한다.)
- ① 10.55
- ② 14.2
- ③ 21.1
- ④ 28.4
등록된 댓글이 없습니다.
47. 다음 신호 중 일반적으로 광원의 세기에 비례하지 않는 것은?
- ① 라만 산란광의 세기
- ② 흡광도(absorbance)
- ③ 형광의 세기
- ④ 인광의 세기
등록된 댓글이 없습니다.
48. 나트륨(Na) 기체의 전형적인 원자흡수 스펙트럼을 옳게 나타낸 것은?
- ① 선(line) 스펙트럼
- ② 띠(bond) 스펙트럼
- ③ 연속(continuous) 스펙트럼
- ④ 선과 띠의 혼합 스펙트럼
등록된 댓글이 없습니다.
49. 분자 질량 분석법에서 진공의 손실을 최소화하면서 시료를 이온화원 지역으로 도입하기 위하여 사용되는 것이 아닌 것은?
- ① 직접 도입 장치
- ② 배치식 도입 장치
- ③ 용해 증발 도입 장치
- ④ 크로마토그래피 및 모세관 전기이동 도입 장치
등록된 댓글이 없습니다.
50. FT-IR 기기와 관련 없는 장치는?
- ① 광원장치
- ② 단색화 장치
- ③ 광검출기
- ④ 미켈슨 인터페로미터
등록된 댓글이 없습니다.
51. 270nm의 파장을 갖는 X선 광자의 광에너지는 약 몇 J인가?
- ① 7.37×10-17
- ② 7.37×10-18
- ③ 7.37×10-19
- ④ 7.37×10-20
등록된 댓글이 없습니다.
52. 분자흡수분광법과 비교하였을 때 분자발광(Iuminescence)법의 가장 큰 장점은 무엇인가?
- ① 검출한계는 몇 ppb 정도로 낮은 범위이다.
- ② 모체 효과(매트릭스, matrix)의 방해가 적다.
- ③ 선형 농도 측정 범위가 작다.
- ④ 흡수법보다 정량 분석에 널리 응용한다.
등록된 댓글이 없습니다.
53. 다음 중 측정된 분석신호화 분석농도를 연관짓기 위한 검정법이 아닌 것은?
- ① 검정곡선법
- ② 표준물첨가법
- ③ 내부표준물법
- ④ 연속광원보정법
등록된 댓글이 없습니다.
54. X-선 형광법의 장점에 대한 설명으로 틀린 것은?
- ① 스펙트럼이 비교적 단순하다.
- ② 시료 손상 없이 분석이 가능하다.
- ③ 원자방출 분광법보다 강도가 좋다.
- ④ 분석과정이 수분 이내로 빠르다.
등록된 댓글이 없습니다.
55. 원자 기체의 흡광도 또는 방출된 복사선을 이용한 분석 방법인 원자분광법에서 유효선 나비의 넓힘 원인으로 틀린 것은?
- ① 도플러 효과
- ② 같은 종류의 원자와 다른 원자들과의 충돌에 기인하는 압력 효과
- ③ 전기장과 자기장 효과
- ④ 중성원자 튕김 효과
등록된 댓글이 없습니다.
56. 원자흡수분광법(AAS)에서 불꽃으로 사용되는 가스를 짝지은 것이다. 이 중 사용되지 않는 것은?
- ① 천연가스-공기
- ② 아세틸렌-산화이질소
- ③ 수소-공기
- ④ 수소-산화이질소
등록된 댓글이 없습니다.
57. 찬증기(cold vapor) 원자화법으로 주로 분석하는 원소는?
- ① Ag
- ② Hg
- ③ Mg
- ④ Na
등록된 댓글이 없습니다.
58. 불꽃을 사용하는 원자화 단계에서 불꽃의 온도가 높을수록 원자화가 잘 일어나지만, 너무 온도가 높으면 중성원자가 양이온과 전자로 이온화되어 흡광도가 떨어진다. 이러한 이온화를 억제하기 위해 첨가하는 이온화 억제제로 가장 적당한 것은?
- ① Mg
- ② Ca
- ③ Cs
- ④ W
등록된 댓글이 없습니다.
59. 적외선 흡수 분광법에서의 시료(sampling)처리 방법에 대한 설명으로 틀린 것은?
- ① 고체시료의 경우는 KBr 펠렛법이 가장 널리 사용된다.
- ② 알콜보다는 벤젠이 sampling 용매로 사용하기에 더 적합하다.
- ③ KBr을 이용하여 고체 시료를 sampling할 때 시료와 KBr의 비율을 1:1~1:5로 하는 것이 일반적이다.
- ④ 액체시료의 경우 순수한 액체시료를 두개의 암염판 사이에 도입하여 분석에 곧바로 이용할 수 있다.
등록된 댓글이 없습니다.
60. 핵자기공명스펙트럼의 화학적 이동에 영향을 주지 않는 것은?
- ① 외부자기장의 세기
- ② 핵 주위의 전자밀도
- ③ 발전기 진동수
- ④ 양자효율
등록된 댓글이 없습니다.
4과목 : 기기분석II
61. 머무름시간이 410초인 용질의 봉우리나비는 바탕선에서 측정해보니 13초이다. 다음의 봉우리는 430초에 용리되었고, 나비는 16초이다. 두 성분의 분리도는?
- ① 1.18
- ② 1.28
- ③ 1.38
- ④ 1.48
등록된 댓글이 없습니다.
62. 유기용매, 식료품, 고분자등 수많은 물질 속에 들어있는 물을 전기량법으로 정량하는 Karl Fisher 장치에 대한 설면 중 틀린 것은?
- ① 산화전극에서 I-로 I2를 발생시킨다.
- ② 물 1몰당 I2 1몰이 소비된다.
- ③ 알코올, 산, SO2가 장치에 반응용액으로 들어있다.
- ④ 일반적으로 발생전극과 종말점 측정을 위한 전극으로 모두 백금전극을 사용한다.
등록된 댓글이 없습니다.
63. 단높이를 나타내는 Van Deemter 식을 올바르게 나타낸 것은? (단, H=단높이, A=다중흐름통로, B=세로확산, C=질량이동, u=이동상의 선형 흐름속도이다.)
- ① H=A+B+C
- ② H=A/u+Bu+C
- ③ H=A+B/u+C/u
- ④ H=A+B/u+Cu
등록된 댓글이 없습니다.
64. 두개 용질의 분리인자(γ)가 1.06일 때 분리도 1.0을 얻기 위하여 필요한 이론단수는?
- ① 3333
- ② 4444
- ③ 5555
- ④ 6666
등록된 댓글이 없습니다.
65. 전압전류법에서 벗김법(stripping method)에 대한 설명으로 틀린 것은?
- ① 전극은 적하수은전극을 사용한다.
- ② 농도가 작을수록 석출시간이 길어진다.
- ③ 예비 농축과정이 포함되므로 감도가 좋다.
- ④ 석출할 때는 작업전극의 전위를 일정하게 유지한다.
등록된 댓글이 없습니다.
66. 질량분석계로 분석할 경우 상대 세기(abundance)가 거의 비슷한 두 개의 동위원소를 갖는 할로겐 원소는?
- ① Cl(chlorine)
- ② Br(bromine)
- ③ F(fluorine)
- ④ I(Iodine)
등록된 댓글이 없습니다.
67. 이온이나 분자들이 벌크용액에서 전극표면층까지 이동하는 경로가 아닌 것은?
- ① 확산
- ② 흡착
- ③ 전기이동
- ④ 대류
등록된 댓글이 없습니다.
68. 질량분석계의 이온화방법 중 고성능액체크로마토그래피나 모세관 전기영동법과 연결하여 사용하는데 가장 적합한 방법은?
- ① 장탈착법(FD:field derorption)
- ② 빠른원자충격법(FAB:fast atom bombar dment)
- ③ 전기분무이온화법(ESI:electrospray ionization)
- ④ 이차이온질량분석법(SIMS:secondary ion mass spectrometry)
등록된 댓글이 없습니다.
69. 초미립 세라믹 분말이나, 세라믹 분말로 만들어진 소재 및 부품들에 존재하는 금속원소들을 분석할 때, 시료를 단일 산이나, 혼합 산으로 녹일 때 잘 녹지 않는 시료들이 많다. 이러한 경우에 시료를 전처리 없이 직접 원자화장치에 도입할 수 있는 방법은 여러 가지가 있다. 다음 중 고체 분말이나, 시편을 녹이지 않고 직접 도입하는 방법이 아닌 것은?
- ① 전열 가열법
- ② 레이저 증발법
- ③ fritted disk 분무법
- ④ 글로우방전법
등록된 댓글이 없습니다.
70. 다음 중 질량분석법에서 m/z비에 따라 질량을 분리하는 장치가 아닌 것은? (단, m은 질량, z는 전하이다.)
- ① 사중극자(quadrupole)분석기
- ② 이중 초점(double focusing)분석기
- ③ 전자 증배관(electron multiplier) 분석기
- ④ 자기장 부채꼴 분석기(magnetic sector analyzer)
등록된 댓글이 없습니다.
71. 막 지시전극에 사용되는 이온선택성 막의 공통적인 특성에 대한 설명으로 틀린 것은?
- ① 이온선택성 막은 분석물질 용액에서 용해도가 거의 0이어야 한다.
- ② 막은 작아도 약간의 전기전도도를 가져야 한다.
- ③ 막속에 함유된 몇 가지 화학종들은 분석물 이온과 선택적으로 결합할 수 있어야 한다.
- ④ 할로겐화은과 같은 낮은 용해도를 갖는 이온성 무기 화합물은 막으로 사용될 수 없다.
등록된 댓글이 없습니다.
72. 다음 중 전위차법에 사용하는 이상적인 기준전극의 조건이 아닌 것은?
- ① 시간이 지나도 일정한 전위를 나타내어야 한다.
- ② 반응이 비가역적이어야 한다.
- ③ 온도가 주기적으로 변해도 과민반응을 나타내지 않아야 한다.
- ④ 작은 전류가 흐른 뒤에도 원래의 전위로 되돌아와야 한다.
등록된 댓글이 없습니다.
73. 갈바니 전지에 대한 설명으로 틀린 것은?
- ① 갈바니 전지는 에너지를 생성할 수 있다.
- ② 산화전극(anode)은 산화가 일어나는 전극이다.
- ③ 전자는 전화전극에서 생성되어 도선을 따라 환원전극으로 흐른다.
- ④ 산화전극을 오른쪽에 환원전극을 왼쪽에 표시한다.
등록된 댓글이 없습니다.
74. 다음 중 양이온 교환체 젤의 활성기가 아닌 것은?
- ① 설포프로필
- ② 인
- ③ 카복시메틸
- ④ 다이에틸아미노에틸
등록된 댓글이 없습니다.
75. 유도결합 플라스마(ICP) 원자방출 광원장치는 원자 방출 및 질량분석기와 결합하여, 금속의 정성 및 정량에 많이 사용되고 있다. 이에 대한 설명으로 틀린 것은?
- ① 무전극으로 광원을 발생시켜, 기존의 다른 방출광원보다 오염가능성이 적다.
- ② 불활성 기체를 사용하여 광원을 발생시켜, 산화물 분자들의 간섭을 줄였다.
- ③ 상대적으로 이온이 많이 발생하여, 쉽게 이온화되는 원소들에 의한 영향이 크다.
- ④ 고온으로서 원자화 및 여기상태로 만드는 효율이 높다.
등록된 댓글이 없습니다.
76. 전기화학 전지에서 염다리의 역할은 무엇인가?
- ① 화학적으로 두 반쪽전지를 결합시켜 준다.
- ② 전기적으로 두 반쪽전지를 연결시켜 준다.
- ③ 두 반쪽전지 사이에서 양쪽 반쪽전지내 이온들과 화학반응을 한다.
- ④ 아무런 화학적 물리적 반응을 하지 않고 양쪽을 분리시킨다.
등록된 댓글이 없습니다.
77. 열무게 측정(thermgravimetry, TG)법에 사용되는 전기로에서 시료가 산화되는 것을 막기 위해 전기로에 넣어주는 기체는?
- ① 산소
- ② 질소
- ③ 이산화탄소
- ④ 수소
등록된 댓글이 없습니다.
78. 시차주사열량법(DSC)은 전이엔탈피와 온도 혹은 반응열을 측정할 수 있으므로 아주 유용하다. 다음 중 DSC의 응용분야로서 가장 거리가 먼 것은?
- ① 상전이과정 측정
- ② 결정화온도 측정
- ③ 고분자물 경화여부 측정
- ④ 휘발성 유기성분 측정
등록된 댓글이 없습니다.
79. 전압전류법에서 세모파의 들뜸 신호를 이용하는 것으로서 유기화합물과 금속-유기화합물계의 산화-환원 반응속도 및 반응메카니즘 연구에 대한 수단으로 주로 이용되는 방법은?
- ① 순환 전압전류법
- ② 네모파 전압전류법
- ③ 펄스차이 폴라로그래피법
- ④ 폴라로그래피 선형주사 전압전류법
등록된 댓글이 없습니다.
80. 전자포착 검출기(Electron Capture Detector)로써 검출감도가 가장 좋은 것은?
- ① 인과 질소를 포함하는 유기화합물
- ② 메르캅탄과 같은 유기 황화합물
- ③ 할로겐(halogen)을 포함하는 유기화합물
- ④ 탄소와 수소를 포함하는 일반적인 탄화수소화합물
등록된 댓글이 없습니다.