9급 지방직 공무원 서울시 화학(2017. 6. 24.) 시험일자 : 2017년 6월 24일
1. 다음 반응식에서 BC 용액의 농도는 0.200M이고 용액의 부피는 250mL이다. 용액이 100% 반응하는 동안 0.6078g의 A가 반응했다면 A의 몰질량은?
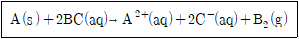
- ① 12.156g/mol
- ② 24.312g/mol
- ③ 36.468g/mol
- ④ 48.624g/mol
등록된 댓글이 없습니다.
2. 돌턴(Dalton)의 원자론에 대한 설명으로 옳지 않은 것은?

- ① 각 원소는 원자라고 하는 작은 입자로 이루어져 있다.
- ② 원자는 양성자, 중성자, 전자로 구성된다.
- ③ 같은 원소의 원자는 같은 질량을 가진다.
- ④ 화합물은 서로 다른 원소의 원자들이 결합함으로써 형성된다.
등록된 댓글이 없습니다.
3. 다음 물질을 끓는점이 높은 순서대로 옳게 나열한 것은?
- ① HF > H2O > NH3 > He
- ② HF > NH3 > H2O > He
- ③ H2O > NH3 > He > HF
- ④ H2O > HF > NH3 > He
등록된 댓글이 없습니다.
4. 96g의 구리가 20℃에서 7.2kJ의 에너지를 흡수할 때, 구리의 최종 온도는? (단, 구리의 비열은 0.385J/g⋅K이고, 온도에 따른 비열 변화는 무시하며, 최종 온도는 소수점 첫째자리에서 반올림한다.)
- ① 195K
- ② 215K
- ③ 468K
- ④ 488K
등록된 댓글이 없습니다.
5. 다음 구조식의 탄소화합물을 IUPAC 명명법에 따라 올바르게 명명한 것은?
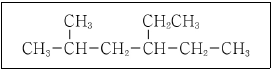
- ① 4 - 에틸- 2 - 메틸헥세인(4 - ethyl - 2 - methylhexane)
- ② 2 - 메틸- 4 - 에틸헥세인(2 - methyl - 4 - ethylhexane)
- ③ 3 - 에틸- 5 - 메틸헥세인(3 - ethyl - 5 - methylhexane)
- ④ 5 - 메틸- 3 - 에틸헥세인(5 - methyl - 3 - ethylhexane)
등록된 댓글이 없습니다.
6. 0.5mol/L의 KOH 수용액을 만들기 위해 KOH 15.4g을 사용했다면 이때 사용한 물의 양은? (단, KOH의 화학식량은 56g이며 사용된 KOH의 부피는 무시한다.)
- ① 0.55L
- ② 0.64L
- ③ 0.86L
- ④ 1.10L
등록된 댓글이 없습니다.
7. 주기율표에서 원소의 주기성에 대한 설명으로 옳지 않은 것은? (단, 원자번호는 Li=3, C=6, O=8, Na=11, Al=13, K=19, Rb=37이다.)
- ① Na은 Al보다 원자 반지름이 크다.
- ② Li은 K보다 원자 반지름이 작다.
- ③ C는 O보다 일차 이온화에너지가 크다.
- ④ K은 Rb보다 일차 이온화에너지가 크다.
등록된 댓글이 없습니다.
8. 다음 그림과 같이 높이는 같지만 서로 다른 양의 물이 담긴 3개의 원통형 용기가 있다. 3번 용기 반지름은 2번 용기 반지름의 2배이고, 1번 용기 반지름은 2번 용기 반지름의 3배이다. 3개 용기 바닥의 압력에 관한 내용으로 옳은 것은?
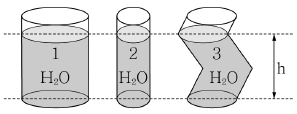
- ① 1번 용기 바닥 압력이 가장 높다.
- ② 2번 용기 바닥 압력이 가장 높다.
- ③ 3번 용기 바닥 압력이 가장 높다.
- ④ 3개 용기 바닥 압력이 동일하다.
등록된 댓글이 없습니다.
9. 원자로에서 우라늄()은 붕괴를 통해 바륨()과 크립톤() 원소가 생성되며, 이 반응을 촉발하기 위해서 중성자 1개가 우라늄에 충돌한다. 반응의 결과물로 생성되는 중성자의 개수는?
- ① 1개
- ② 2개
- ③ 3개
- ④ 4개
등록된 댓글이 없습니다.
10. 다음은 금속나트륨이 염소기체와 반응하여 고체상태의 염화나트륨을 생성하는 반응이다. [ Na(s)+1/2⋅Cl2(g)→NaCl(s) ] 이 반응의 전체 에너지 변화(△E)는?

- ① -410kJ/mol
- ② -290kJ/mol
- ③ 290kJ/mol
- ④ 410kJ/mol
등록된 댓글이 없습니다.
11. SO2 분자의 루이스 구조가 다음과 같은 형태로 되어 있을 때, 각 원자의 형식전하를 모두 더한 값은?
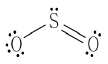
- ① -2
- ② -1
- ③ 0
- ④ 1
등록된 댓글이 없습니다.
12. 이산화질소와 일산화탄소의 반응 메커니즘은 다음의 두 단계를 거친다. 이에 대한 설명으로 옳지 않은 것은? (단, 단계별 반응 속도상수는 k1≪k2의 관계를 가진다.)
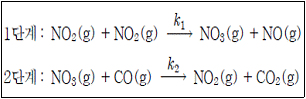
- ① 반응 중간체는 NO3(g)이다.
- ② 반응속도 결정단계는 1단계 반응이다.
- ③ 1단계 반응은 일분자 반응이고, 2단계 반응은 이분자 반응이다.
- ④ 전체반응의 속도식은 k1[NO2]2이다.
등록된 댓글이 없습니다.
13. 옥사이드 이온(O2-)과 메탄올(CH3OH) 사이의 반응은 다음과 같다. 브뢴스테드-로리 이론(Bro̸rnsted-Lowry theory)에 따른 산과 염기로 옳은 것은?
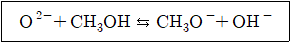
- ① 산 : O2-, OH-, 염기 : CH3OH, CH3O-
- ② 산 : CH3OH, OH-, 염기 : O2-, CH3O-
- ③ 산 : O2-, CH3O-, 염기 : CH3OH, OH-
- ④ 산 : CH3OH, CH3O-, 염기 : O2-, OH-
등록된 댓글이 없습니다.
14. 어떤 전이금속 이온의 5개 d 전자궤도함수는 동일한 에너지 준위를 이루고 있다. 이 전이금속 이온이 4개의 동일한 음이온 배위를 받아 정사면체 착화합물을 형성할 때 나타나는 에너지 준위 도표로 옳은 것은?
- ①
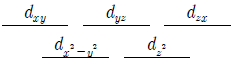
- ②
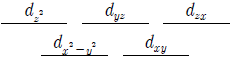
- ③
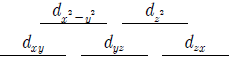
- ④
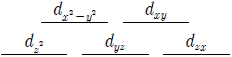
등록된 댓글이 없습니다.
15. n-형 반도체는 실리콘에 일정량의 불순물 원자를 첨가하는 도핑(doping)과정을 통해 제조할 수 있다. 다음 중 n-형 반도체를 제조하기 위해 사용되기 어려운 원소는 무엇인가?
- ① 15P
- ② 33As
- ③ 49In
- ④ 51Sb
등록된 댓글이 없습니다.
16. 일정한 압력에서 일어나는 어느 반응에 대해 온도에 따른 Gibbs 자유에너지 변화(△G)는 다음과 같다. 이 그림에 대한 설명으로 옳지 않은 것은?
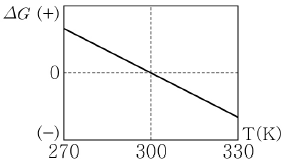
- ① 엔트로피 변화(△S)는 양수이다.
- ② 이 계는 300K에서 평형상태에 있다.
- ③ 이 반응은 온도가 300K보다 높을 때 자발적으로 일어난다.
- ④ 이 반응의 엔탈피 변화(△H)는 음수이다.
등록된 댓글이 없습니다.
17. 25℃의 물에서 Cd(OH)2(s)의 용해도를 S라고 할 때, Cd(OH)2(s)의 용해도곱 상수(solubility product constant, Ksp)로 옳은 것은?
- ① 2S2
- ② S3
- ③ 2S3
- ④ 4S3
등록된 댓글이 없습니다.
18. 양성자 교환막 연료 전지는 수소기체와 산소기체가 만나 물을 얻는 반응을 이용하여 전기를 생산한다. 이때 산화전극에서 일어나는 반쪽 반응은 다음과 같다. [ 2H2(g) → 4H+(aq) + 4e- ] 다음 중 환원전극에서 일어나는 반쪽 반응으로 옳은 것은?
- ① O2(g) + 4H+(aq) + 4e- → 2H2O(l)
- ② O2(g) + 2H2(g) → 2H2O(l)
- ③ H+(aq) + OH-(aq) → H2O(l)
- ④ 2H2O(l) → 4H+(aq) + 4e- + O2(g)
등록된 댓글이 없습니다.
19. 일산화탄소, 수소 및 메탄올의 혼합물이 평형상태에 있을 경우, 화학 반응식은 다음과 같다. [ CO(g) + 2H2(g) ⇄ CH3OH(g) ] 이때 혼합물의 조성이 CO 56g, H2 5g, CH3OH 64g이라고 할 때 평형상수(Kc)의 값은? (단, 분자량은 CO=28g, H2=2g, CH3OH=32g이다.)
- ① 0.046
- ② 0.16
- ③ 0.23
- ④ 0.40
등록된 댓글이 없습니다.
20. 6×10-3M H3O+이온을 함유한 아세트산 수용액의 pH는? (단, log2=0.301, log3=0.477이며, 소수점 셋째 자리에서 반올림한다.)
- ① 2.22
- ② 2.33
- ③ 4.67
- ④ 4.78
등록된 댓글이 없습니다.