화학분석기사(2013. 3. 10.) 시험일자 : 2013년 3월 10일
1과목 : 일반화학
1. 납 원자 2.55×1023개의 질량은 약 몇 g인가? (단, 납의 원자량은 207.2이다.)
- ① 48.8
- ② 87.8
- ③ 488.2
- ④ 878.8
등록된 댓글이 없습니다.
2. 25℃에서 용해도곱 상수(Ksp)가 1.6×10-5d일 때, 염화 납(Ⅱ)(PbCl2)의 용해도(mol/L)는 얼마인가?
- ① 1.6×10-2
- ② 0.020
- ③ 7.1×10-5
- ④ 2.1
등록된 댓글이 없습니다.
3. 탄화수소 화합물에 대한 설명으로 틀린 것은?
- ① 탄소-탄소 결합이 단일결합으로 모두 포화된 것을 alkane이라 한다.
- ② 탄소-탄소 결합에 이중결합이 있는 탄화수소 화합물은 alkene이라 한다.
- ③ 탄소-탄소 결합에 삼중결합이 있는 탄화수소 화합물은 alkyne이라 한다.
- ④ 가장 간단한 alkyne 화합물은 프로필렌(C3H4)이다.
등록된 댓글이 없습니다.
4. 철근이 녹이 슬 때 질량은 어떻게 되겠는가?
- ① 녹슬고 전과 질량 변화가 없다.
- ② 녹슬기 전에 비해 질량이 증가한다.
- ③ 녹이 슬면서 일정 시간 질량이 감소하다가 일정하게 된다.
- ④ 녹슬기 전에 비해 질량이 감소한다.
등록된 댓글이 없습니다.
5. 다음 방향족 화합물 구조의 명칭에 해당하는 것은?
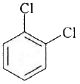
- ① ortho-dichlorobenzene
- ② meta-dichlorobenzene
- ③ paea-dichlorobenzene
- ④ delta-dichlorobenzene
등록된 댓글이 없습니다.
6. 다음 중 흡열 반응이 아닌 것은?
- ① 자동차 엔진에서 가솔린의 연소
- ② 뜨거운 표면 위에서 물의 증발
- ③ 드라이아이스가 기체 이산화탄소로 승화
- ④ 얼음이 녹아 물로 바뀜
등록된 댓글이 없습니다.
7. 몰농도(M. molarity)의 정의로 옳은 것은?
- ① 용매 1L중에 녹아 있는 용질의 몰수
- ② 용액 1L중에 녹아 있는 용질의 몰수
- ③ 용매 1kg중에 녹아 있는 용질의 몰수
- ④ 용액 1L중에 녹아 있는 용매의 몰수
등록된 댓글이 없습니다.
8. 다음의 산화환원반응식에 대한 설명 중 틀린 것은?
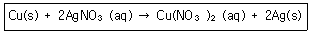
- ① 산화수 0의 구리(Cu)는 반응 후에 +2로 산화수가 증가하였다.
- ② 구리(Cu)는 전자 2개를 얻어 산화된다.
- ③ 은이온(Ag+)은 산화수가 +1에서 반응 후에는 0의 산화수를 갖는다.
- ④ 2개의 은이온(Ag+)은 각각 1개씩 전자를 얻어 환원된다.
등록된 댓글이 없습니다.
9. 다음 중 산의 세기가 가장 강한 것은?
- ① HCIO
- ② HF
- ③ CH3COOH
- ④ HCl
등록된 댓글이 없습니다.
10. 어떤 상태에서 탄소(C)의 전자 배치가 1s22s22px2로 나타났다. 이 전자배치에 대하여 옳게 설명한 것은?
- ① 들뜬 상태, 짝짓지 않은 전자 존재
- ② 들뜬 상태, 전자는 모두 짝지었음
- ③ 바닥 상태, 짝짓지 않은 전자 존재
- ④ 바닥 상태, 전자는 모두 짝지었음
등록된 댓글이 없습니다.
11. 이온반지름의 크기를 잘못 비교한 것은?
- ① Mg2+>Ca2+
- ② F-<02-
- ③ Al3+<Mg2+
- ④ 02-<S2-
등록된 댓글이 없습니다.
12. KMnO4에서 Mn의 산화수는 얼마인가?
- ① 4
- ② 5
- ③ 6
- ④ 7
등록된 댓글이 없습니다.
13. 화합물 5.325g은 탄소 3.758g, 수소 0.316g, 산소 1.251g으로 이루어져 있다. 이 화합물의 실험식을 옳게 나타낸 것은?
- ① C2H4O
- ② CH2O
- ③ C4H4O
- ④ C6H6O
등록된 댓글이 없습니다.
14. 메탄 4g은 몇 몰(mol)인가?
- ① 0.125 몰
- ② 0.25 몰
- ③ 0.5 몰
- ④ 4.0 몰
등록된 댓글이 없습니다.
15. 다음 산의 명명법으로 옳은 것은?
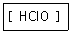
- ① 염소산
- ② 아염소산
- ③ 과염소산
- ④ 하이포아염소산
등록된 댓글이 없습니다.
16. 아세트산, 아세틸렌, 에탄, 에틸알코올 중 화합물 내 탄소의 함량(질량 %)이 감소하는 순서로 배열한 것은?
- ① 아세틸렌>에탄>에틸알코올>아세트산
- ② 에탄>아세틸렌>에틸알코올>아세트산
- ③ 아세트산>에틸알코올>에탄>아세틸렌
- ④ 에틸알코올>아세트산>아세틸렌>에탄
등록된 댓글이 없습니다.
17. 다음 중 실험식이 다른 것은?
- ① CH2O
- ② C2H6O2
- ③ C6H12O6
- ④ C3C6O3
등록된 댓글이 없습니다.
18. 원자 내에서 전자는 불연속적인 에너지 준위에 따라 배치된다. 이러한 주에너지 준위 중에서 전자가 분포할 확률을 나타낸 공간을 무엇이라 부르는가?
- ① 원자핵
- ② Lewis 구조
- ③ 전위(potential)
- ④ 궤도함수
등록된 댓글이 없습니다.
19. 다음 중 질량 백분율(mass percentage)에 대한 설명으로 옳은 것은?
- ① (용질의 질량/용액의 질량)×102
- ② (용질의 질량/용매의 질량)×102
- ③ (용질의 질량/용액의 몰수)×102
- ④ (용질의 질량/용매의 몰수)×102
등록된 댓글이 없습니다.
20. 티오시아네이트(Thiocyanate) 이온(SCN-)의 전자구조를 옳게 나타낸 것은?
- ①
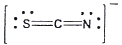
- ②
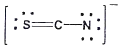
- ③

- ④
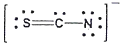
등록된 댓글이 없습니다.
2과목 : 분석화학
21. 진한 황산의 무게 백분율 농도는 96%이다. 진한 황산의 몰농도는 얼마인가? (단, 진한 황산의 밀도는 1.84kg/L, 황산의 분자량은 98.08g/mol이다.)
- ① 9.00M
- ② 12.0M
- ③ 15.0M
- ④ 18.0M
등록된 댓글이 없습니다.
22. 메틸아민(Methylamine)은 약한 염기로 염해리상수(Kb)값은 다음과 같은 평형식에서 구할 수 있다. Kb값을 구하기 위한 표현식으로 옳은 것은?
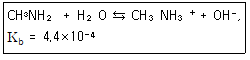
- ① [CH3NH3+]/[CH3NH2]
- ② [CH3NH2]/([CH3NH3+][OH-])
- ③ ([CH3NH3+][OH-])/[CH3NH2]
- ④ [CH3NH3+]/([CH3NH2][H+])
등록된 댓글이 없습니다.
23. 금이 왕수에서 녹을 때 미량의 금이 산화제인 질산에 의해 이온이 되어 녹으면 염소 이온과 반응해서 제거되면서 계속 녹는다. 이 때 금 이온과 염소 이온 사이의 반응은?
- ① 산화-환원
- ② 침전
- ③ 산-염기
- ④ 착물형성
등록된 댓글이 없습니다.
24. 활동도계수(Activity Coefficient)에 대한 설명으로 옳은 것은?
- ① 이온의 크기가 같을 때 이온세기(ionic strength)가 증가하면 활동도계수는 증가한다.
- ② 이온의 크기가 같을 때 이온의 전하가 증가하면 활동도 계수는 증가한다.
- ③ 이온의 전하가 같을 때 수화된(hydrated) 이온 크기가 증가하면 활동도계수는 증가한다.
- ④ 이온의 농도가 묽은 용액일수록 활동도계수는 1보다 커진다.
등록된 댓글이 없습니다.
25. 표준 수소 전극에서의 반응 및 표준 전위(E°)를 가장 옳게 나타낸 것은? (단, A는 각 성분의 활동도이다.)
- ① 2H+(A=1)+2e-⇆H2(A=2) E°=0.0V
- ② 2H+(A=2)+2e-⇆H2(A=1) E°=1.0V
- ③ 2H+(A=1)+2e-⇆H2(A=1) E°=0.0V
- ④ 2H+(A=2)+2e-⇆H2(A=2) E°=1.0V
등록된 댓글이 없습니다.
26. 산화ㆍ환원 적정에서 사용되는 KMnO4에 대한 설명으로 틀린 것은?
- ① 진한 자주색을 띤 산화제이다.
- ② 매우 안정하여 일차표준물질로 사용된다.
- ③ 쎈 산성용액에서 무색의 Mn2+로 환원된다.
- ④ 산성용액에서 자체지시약으로 작용한다.
등록된 댓글이 없습니다.
27. 표준전극전위, E°에 대한 다음 설명 중 틀린 것은?
- ① 반쪽반응의 표준전극전위는 온도의 영향을 받는다.
- ② 표준전극전위는 균형 맞춘 반쪽반응의 반응물과 생성물의 몰수와 관계가 있다.
- ③ 반쪽반응의 표준전극전위는 전적으로 환원반응의 경우로만 나타난다. 즉, 상태환원전위가 된다.
- ④ 표준전극전위는 산화전극 전위를 임의로 0.000V로 정한 표준수소전극인 화학전지의 전위라는 면에서 상대적인 양이다.
등록된 댓글이 없습니다.
28. 암모니아의 존재 하에서 Zn2+용액을 EDTA로 적정하였다. 이 조건에서 유리 금속 이온의 분율은 1.8×10-5이고 Zn2+-EDTA 형성상수는 3.16×1016 이다. pH 10.0과 11.0일 대의 EDTA Y4-의 분율은 0.36과 0.85이다. 용액의 pH가. 10.0일 때 당량점에서의 Zn2+의 농도가 1.0×10-14M이었다면, 용액의 pH가 11.0일 때 당량점에서의Zn2+의 농도는?
- ① 2.36×10-14M
- ② 8.50×10-15M
- ③ 4.23×10-15M
- ④ 3.60×10-15M
등록된 댓글이 없습니다.
29. CH3COO-/CH3COOH 완충용액의 pH가 4.98이고, 이 때 [CH3COO-]=0.1M이다. 이 용액 200mL에 0.1M NaOH 용액 10mL를 가한 후의 완충용액의 pH는 얼마인가? (단, CH3COOH의 Ka=1.75×10-5이다.)
- ① 4.98
- ② 5.04
- ③ 5.98
- ④ 6.04
등록된 댓글이 없습니다.
30. 칼슘이온 Ca2+을 무게분석법을 활용하여 정량하고자 한다. 이 때 효과적으로 사용할 수 있는 음이온은?
- ① C2O42-
- ② CO42-
- ③ Cl-
- ④ SCN-
등록된 댓글이 없습니다.
31. 부피분석방법 중 하나인 적정법에서 이용되는 화학반응이 가져야 할 조건으로 가장 거리가 먼 것은?
- ① 측정되는 성분화학종은 표준시약과 화학양론적으로 반응하여야 한다.
- ② 반응이 정량적으로 진행되며, 역반응이 일어나지 않아야 한다.
- ③ 반응속도가 느려야 한다.
- ④ 반응의 종말점은 외부에서 명확하게 인정할 수 있어야 한다.
등록된 댓글이 없습니다.
32. 0.850g의 미지시료에는 KBr(몰 질량 119g)과 KNO3(몰 질량 101g) 만이 함유되어 있다. 이 시료를 물에 용해한 후 브롬화물을 완전히 적정하는데 0.0500M AgNO3 80.0mL가 필요하였다. 이 때 고체시료에 있는 KBr의 무게백분율은?
- ① 44.0%
- ② 47.5%
- ③ 54.1%
- ④ 56.0%
등록된 댓글이 없습니다.
33. HgS는 산성과 알칼리성 H2S 용액 모두에서 침전되고, ZnS는 알칼리성 H2S 용액서만 침전된다. 이로부터 용해도곱 상수의 크기에 대하여 알 수 있는 것은?
- ① HgS가 더 작다.
- ② ZnS가 더 작다.
- ③ 같다.
- ④ 알 수 없다.
등록된 댓글이 없습니다.
34. 프탈산의 K1=1.12×10-3이고, K2=3.90×10-6이다. 0.050M 프탈산 30.0mL를 0.10M NaOH로 적정하였다. NaOH를 30.0mL 가했을 때의 pH는?
- ① 3.90
- ② 5.90
- ③ 7.0
- ④ 8.90
등록된 댓글이 없습니다.
35. 옥살산(H2C2O4)은 뜨거운 산성용액에서 과망간산 이온(MnO4-)과 다음과 같이 반응한다. 이 반응에서 지시약 역할을 하는 것은?
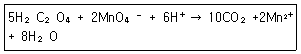
- ① H2C2O4
- ② MnO4-
- ③ CO2
- ④ H2O
등록된 댓글이 없습니다.
36. 해리 평형상수가 1.0×10-5인 약산이 있다. 이 약산의 농도가 0.10M일 때의 해리분율(fraction of dissociation)은?
- ① 1.0%
- ② 2.0%
- ③ 5.0%
- ④ 10.0%
등록된 댓글이 없습니다.
37. 옥살산나트륨의 제조 과정에 대한 설명으로 틀린 것은?
- ① KMnO4 용액을 표준화하기 위해 옥살산나트륨(Ma2C2O4, 134.00g/mol) 0.3562g을 250.0mL 부피 플라스크에 녹여 만들었다. 옥살산 농도는 0.01063M이다.
- ② 옥살산(C2O4-) 5mol은 MnO4- 2mol과 반응한다.
- ③ 0.01063M Na2C2O4 10.00mL와 반응하는 KMnO4 몰수는 0.04252mmol이다.
- ④ 0.01063M Na2C2O4 10.00mL와 반응하는 KMnO4량이 48.36mL이면 KMnO4의 농도는 0.008792M이다.
등록된 댓글이 없습니다.
38. 다음은 Potassium tartrate의 용해도가 첨가물의 농도에 따라 어떻게 변화되는가를 나타내는 그림이다. 그림의 (a), (b), (c)는 각각 어떤 첨가물로 예상할 수 있는가? (단, 첨가물의 종류는 MaCl, Glucose, KCl이다.)
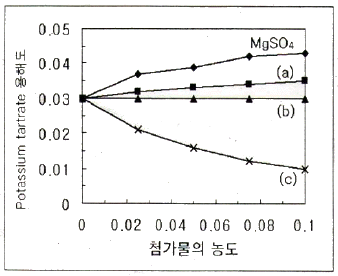
- ① (a) NaCl, (b) Glucose, (c) KCl
- ② (a) NaCl, (b) KCl, (c) Glucose
- ③ (a) KCl, (b) NaCl, (c) GlucoseKCl
- ④ (a) Glucosel, (b) KCl, (c) NaCl
등록된 댓글이 없습니다.
39. 완충용액을 다루는 주된 식은 Handerson-Hasselbalch 식으로서, 이 식을 활용하면 완충용액의 pH값을 용액의 조성으로부터 쉽게 예상할 수 있다. 약산 HA와 그 짝염기 A-로 구성된 완충용액의 Handerson-Hasselbalch식을 바르게 나타낸 것은?
- ①
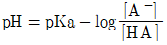
- ②
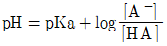
- ③
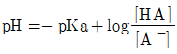
- ④
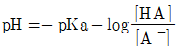
등록된 댓글이 없습니다.
40. 농도(Concentration)에 대한 설명으로 옳은 것은?
- ① 몰랄 농도[m]는 온도에 따라 변하지 않는다.
- ② 몰랄 농도는 용액 1kg 중 용질의 몰수이다.
- ③ 몰 농도[M]는 용액 1kg 중 용질의 몰수이다.
- ④ 몰 농도는 온도에 따라 변하지 않는다.
등록된 댓글이 없습니다.
3과목 : 기기분석I
41. 불꽃 원자분광법에서 휘발성이 낮은 화학종의 생성에 의한 방해를 줄일 수 있는 방법이 아닌 것은?
- ① 가능한 한 높은 온도의 불꽃을 사용한다.
- ② 해방제를 사용한다.
- ③ 복사선 완충제를 사용한다.
- ④ 보호제를 사용한다.
등록된 댓글이 없습니다.
42. X-선의 회절에 이용되는 대표적인 법칙은?
- ① Bragg 법칙
- ② Raman 법칙
- ③ Beer 법칙
- ④ Hunt 법칙
등록된 댓글이 없습니다.
43. 적외선 분광법에서 1600~1700cm-1 근처에서 강한 피크와 3000cm-1 근처에서 넓고 강한 피크를 갖고 있는 스펙트럼을 얻었다. 다음 중 가능성이 가장 높은 화합물은?
- ① C6H5CH3
- ② CH3COCH3
- ③ CH3COOH
- ④ CH3OH
등록된 댓글이 없습니다.
44. Bi(Ⅲ)와 티오우레아간에 형성된 착물을 포함하는 용액은 470nm에서 9.32×103Lmol-1cm-1의 몰흡광계수를 가진다. 1.0cm 용기에서 6.24×10-5M 용액의 흡광도는 얼마인가?
- ① 0.382
- ② 0.482
- ③ 0.582
- ④ 0.682
등록된 댓글이 없습니다.
45. 원자 흡수법에서 사용되는 보호제(protective agent)의 목적으로 사용되는 시약으로만 나열된 것은?
- ① EDTA, 8-hydroxyqinoline, APDC
- ② EDTA, APDC, 해방제
- ③ EDTA, 8-hydroxyqinoline, 해방제
- ④ 8-hydroxyqinoline, APDC, 해방제
등록된 댓글이 없습니다.
46. 양성자와 13C 원자사이에 짝풀림을 하는 여러 가지 방법이 있다. 13C NMR에 이용하는 짝풀림이 아닌 것은?
- ① 넓은 띠 짝풀림
- ② 공명 비킴 짝풀림
- ③ 펄스 배합 짝풀림
- ④ 자기장 잠금 짝풀림
등록된 댓글이 없습니다.
47. 이산화탄소 분자는 모두 몇 개의 기준진동방식을 가지는가?
- ① 3
- ② 4
- ③ 5
- ④ 6
등록된 댓글이 없습니다.
48. 기기분석에서 분석 신호는 화학적 잡음과 기기적 잡음의 영향을 받는다. 다음 중 기기적 잡음에 속하지 않는 것은?
- ① 산탄(shot) 잡음
- ② 열적(thermal) 잡음
- ③ 깜박이(flicker) 잡음
- ④ 열역학적(thermodynamic) 잡음
등록된 댓글이 없습니다.
49. 유도결합플라스마 토치에 시료를 도입하는 방법이 아닌 것은?
- ① 압력주입법
- ② 교차흐름 분무기법
- ③ 초음파 분무기법
- ④ 전열 증가화법
등록된 댓글이 없습니다.
50. X-선 분광법에 사용되는 광원이 아닌 것은?
- ① 방사성동위원소
- ② X-선 관
- ③ 2차 형광 광원
- ④ 전극 없는 방전등
등록된 댓글이 없습니다.
51. 레이저 발생 원리에 따르면 세 단계 준위보다 네 단계 준위 레이저가 더 효율적이다. 이와 관련이 있는 원리는?
- ① 자발 방출
- ② 흡수
- ③ 분포상태반전
- ④ 펌핑
등록된 댓글이 없습니다.
52. 불꽃 및 전열법과 비교한 ICP 원자화 방법의 특징에 대한 설명으로 틀린 것은?
- ① 자체흡수와 자체반전 효과가 작다.
- ② ㅏ 이온화에 의한 방해효과가 작다.
- ③ 저렴한 장비를 사용하고 유지비가 적게 든다.
- ④ 텅스텐, 우라늄, 지르코늄 등의 원자화가 용이하다.
등록된 댓글이 없습니다.
53. UV-Vos 흡수 분광법에서 용매의 선정은 아주 중요하다. 가장 낮은 투과 파장을 갖는 용매는?
- ① 물
- ② 에틸알코올
- ③ 아세톤
- ④ 벤젠
등록된 댓글이 없습니다.
54. 원자 V-선 분광법에서 사용하는 Geiger관을 사용한 변환기에 대한 설명으로 틀린 것은?
- ① 복사선의 세기는 전류의 펄스로 측정한다.
- ② 불감시간이 짧아 다른 검출기에 비해 계수범위가 넓다.
- ③ 기체충전 변환기이며, 신호세기가 커서 검출이 비교적 쉽다.
- ④ 관에는 아르곤 기체로 채워져 있으며, 알코올이나 메탄을 소량 첨가한다.
등록된 댓글이 없습니다.
55. 다음 광자 변환기(photon transducer) 중 자외선 영역에 가장 좋은 감도를 나타내며, 감응시간이 매우 빠르나 열적방출로 인하여 냉각장치가 필요한 것은?
- ① 규소다이오드검출기(silicon diode detector)
- ② 광전압전지(Photoboltaic cell)
- ③ 전하-쌍 장치(charge-coupled device)
- ④ 광전증배관(photomultipller tube)
등록된 댓글이 없습니다.
56. FT(퓨리에변환) 분광법은 적외선 분광광도법이나 NMR에서 많이 사용된다. 분산형 기기와 비교하였을 때 FT 분광법의 장점이 아닌 것은?
- ① 신호/잡음 비가 증가된다.
- ② 주파수가 더 정확하다.
- ③ 빠른 시간에 측정된다.
- ④ 회절발의 성능이 우수하다.
등록된 댓글이 없습니다.
57. 전자전이가 일어날 때 자외선-가시광선의 흡수가 일어난다. 다음 중 몰흡광계수가 일반적으로 가장 큰 전자 전이는?
- ① n→σ*
- ② π→π*
- ③ σ→σ*
- ④ π→σ*
등록된 댓글이 없습니다.
58. 1064nm의 빛이 회절발에서 30°로 입사하여 60°로 반사되었다. 이 회절발의 홈 수를 두 배로 늘린다고 가정하면 2차 반사(n=2)에 대한 파장은 어떻게 되겠는가?
- ① 1064nm
- ② 532nm
- ③ 266nm
- ④ 133nm
등록된 댓글이 없습니다.
59. 다음 화합물 해당원소의 H 또는 13C NMR 스펙트럼의 봉우리 위치를 올바르게 나타낸 것은?
- ① 벤젠의 수소:4~5ppm 내에서 나타남
- ② 벤젠의 탄소:160~210ppm 내에서 나타남
- ③ 아세톤의 수소:4~6ppm 내에서 나타남
- ④ 아세톤의 카르보닐탄소:190~220ppm 내에서 나타남
등록된 댓글이 없습니다.
60. 루미네센스(Luminescence)방법의 특징이 아닌 것은?
- ① 정량분석에 널리 응용된다.
- ② 선형 농도 측정 범위가 넓다.
- ③ 시료 매트릭스부터 방해 효과를 받기 쉽다.
- ④ 검출한계가 낮다.
등록된 댓글이 없습니다.
4과목 : 기기분석II
61. 고성능 액체크로마토그래피(HPLC)에 이용되는 굴절률검출기(I detector)의 특징에 대한 설명으로 옳은 것은?
- ① 특정 시료에 선택성이 크다.
- ② 감도가 높아 미량분석에 적합하다.
- ③ 온도에 예민하다.
- ④ 기울기 용리가 가능하다.
등록된 댓글이 없습니다.
62. 이온크로마토그래피를 이용하여 측정할 경우, 보통 검출기는 전도도를 재는 전기화학적 검출기를 사용하나, 흐름용액의 전해질 때문에 바탕세기가 높아 감도가 좋지 않다. 이 때 시료의 감도를 획기적으로 높이기 위하여 사용하는 것은?
- ① Guard column
- ② Suppressor
- ③ 형광 검출기
- ④ 이온선택교환수지
등록된 댓글이 없습니다.
63. 이온 사이클로트론 공명(ion cyclotron resonance) 현상을 이용하는 질량분석기는?
- ① 사중극자(quadrupole) 분석기
- ② 이온포착(ion trap) 분석기
- ③ 비행시간(time-of-flight)분석기
- ④ 자기장 부채꼴(magoeticsector)
등록된 댓글이 없습니다.
64. 25℃에서 0.010M Fe3+와 0.100M Fe2+의 용액에 담근 Pt 전극으로 된 반쪽전지의 전위는 몇 V 인가?

- ① +0. 712
- ② +0. 742
- ③ +0. 801
- ④ +0. 830
등록된 댓글이 없습니다.
65. 크로마토그래피에서 단 높이(Plate Height)에 대한 설명으로 옳은 것은?
- ① 단 높이가 낮으면 띠나비(bandwidth)는 좁아진다.
- ② 이론 단 하나의 높이(height equivalent to a theoretical plate) 라고도 불린다.
- ③ 단 높이가 감소하면 분리가 잘 되지 않는다.
- ④ 단 높이가 감소하면 분리가 잘 되지 않는다.
화분기052025. 2. 18. 21:40삭제
옳지 않은 것
ala2024. 7. 17. 16:45삭제
문제수정
③ 단높이가 감소하면 단의 개수는 증가한다.
66. 분자질량분석법에서는 동위원소의 존재비를 이용하여 M+1봉우리를 계산하여 분자량 봉우리를 확인한다. 원소에 대한 존재비율 중 잘못된 것은?
- ① 탄소-13 : 1.08%
- ② 수소-2 : 0.15%
- ③ 질소-15 : 0.37%
- ④ 산소-18 : 0.20%
ala2024. 7. 17. 16:44삭제
수소- 0.015
67. 선택계수(selectivity coefficient, α)는 다음 중 무엇을 나타내는가?
- ① 두 분석 물질 간의 상대적인 이동 속도
- ② 분석 물질의 띠 넓어짐의 정도
- ③ 이동상의 이동 속도
- ④ 분석 가능한 물질의 최대수
등록된 댓글이 없습니다.
68. 질량분석법에 사용되는 이온화법 중 기체상태에서 이온화 시키는 방법이 아닌 것은?
- ① 전자충격 이온화(EI)
- ② 매트릭스 지원 탈착 이온화(MALDI)
- ③ 장 이온화(FI)
- ④ 화학적 이온화(CI)
등록된 댓글이 없습니다.
69. 크기별 배제(size exclusion)크로마토그래피에 대한 설명으로 틀린 것은?
- ① 분리 시간이 비교적 짧고 시료 손실이 없다.
- ② 이성질체와 같이 비슷한 크기의 시료의 분리에 적합한다.
- ③ 거대 중합체나 천연불의 분자량 또는 분자량 분포를 측정할 수 있다.
- ④ 분석불과 정지상(stationary phase)사이에 화학적, 물리적 상호작용이 일어나지 않는다.
등록된 댓글이 없습니다.
70. 질량분석법에서 시료의 이온화 과정은 매우 중요하다. 전기장으로 가속시킨 전자 또는 음으로 하전된 이온을 시료 분자에 충격하면 시료 분자의 양이온을 얻을 수 있다. 2가로 하전된 이온(질량 3.32×10-26kg)을 104V의 전기장으로 가속시켜 시료분자에 충격하려한다. 다음 설명 중 틀린 것은? (단, 전자의 전하는 1.6×10-19C이다.)
- ① 이 이온의 운동에너지는 3.2×10-15J 이다.
- ② 이 이온의 속도는 1.39×104m/sec이다.
- ③ 질량이 6.64×10-26kg인 이온을 이용하면 운동에너지는 2배가 된다.
- ④ 같은 양의 운동에너지를 갖는다면 가장 큰 질량을 가진 이온이 가장 느린 속도를 갖는다.
등록된 댓글이 없습니다.
71. 질량분석법에 대한 설명으로 틀린 것은?
- ① 분자이온봉우리가 미지시료의 분자량을 알려주기 때문에 구조결정에 중요하다.
- ② 가상의 분자 ABCD에서 BCD+는 딸-이온(daughter-ion)이다다.
- ③ 질량 스펙트럼에서 가장 큰 봉우리의 크기를 임의로 100으로 정한 것이 기준봉우리이다.
- ④ 질량 스펙트럼에서 분자이온보다 질량수가 큰 봉우리는 생기지 않는다.
등록된 댓글이 없습니다.
72. 이온선택성 막전극이 갖추어야 할 성질로 틀린 것은?
- ① 약간의 전기전도도를 가져야 한다.
- ② 분석물 용액에 잘 용해되어야 한다.
- ③ 분석물 이온과 선택적 반응성을 가져야 한다.
- ④ 이온교환, 결정화 및 착물형성 등의 방법으로 분석물과 결합할 수 있어야 한다.
등록된 댓글이 없습니다.
73. 분자량이 큰 글루코오스 계열의 혼합물을 분리하고자 할 때 가장 적합한 크로마토그래피는?
- ① 겔 투과 액체 크로마토그래피
- ② 이온 교환 크로마토그래피
- ③ 분비 액체 크로마토그래피
- ④ 흡착 액체 크로마토그래피
등록된 댓글이 없습니다.
74. 열분석은 물질의 특이한 물리적 온도의 함수로 측정하는 기술이다. 열분석 종류와 측정방법을 연결한 것 중 잘못된 것은?
- ① 시차주사열량법(DSC)-열과 전이 및 반응온도
- ② 시차열분석(DTA)-전이와 반응온도
- ③ 열무게(TGA)-크기와 점도의 변화
- ④ 방출기체분석(EGA)-열적으로 유도된 기체생성물의 양
등록된 댓글이 없습니다.
75. 유도결합플라스마질량분석법(ICPMS)에서 스펙트럼의 방해에 영향을 주지 않는 화학종은?
- ① 동중핵 이온(isobaric ion)
- ② 다원자 이온(polyatomic ion)
- ③ 이중 하전 이온(doubly charged ion)
- ④ 중성의 아르곤 원자(neutral argon atom)
등록된 댓글이 없습니다.
76. 전기분해 시 사용되는 일정전위기(potentiostat)에 대한 설명으로 틀린 것은?
- ① 전기분해의 선택성을 높일 수 있다.
- ② 작업전극에 흐르는 전류를 일정하게 유지시키는 장치이다.
- ③ 작업전극의 전위를 기준전극에 대해 일정하게 유지한다.
- ④ 주로 작업전극, 기준전극, 보조전극의 3전극계를 사용한다.
등록된 댓글이 없습니다.
77. 칼로멜 전극(calomel electrode)에 대한 설명으로 틀린 것은?
- ① 전극반응은 HgCl2(s)+2e-↔2Hg(L)+2Cl-이다.
- ② 염소이온과 수은의 농도에 따라 전극전위가 변한다.
- ③ 전극의 내부 관에는 Hg, Hg2Cl2, 포화 KCl 용액이 들어 있다.
- ④ 기준전극(reference electrode)으로 사용된다.
등록된 댓글이 없습니다.
78. 원자질량 스펙트럼에서의 분광학적 방해에 해당하지 않는 것은?
- ① 다원자 이온 방해
- ② 동중핵 방해
- ③ 비휘발성 방해
- ④ 산화물 및 수산화물 화학종 방해
등록된 댓글이 없습니다.
79. 크로마토그래피에서 물질 A와 B를 분리하기 위해 16cm 관을 사용하였다. A와 B의 머무름 시간은 각각 10분과 11분이고 이동상의 평균이동속도는 5cm/분이었다. A와 B의 밑변의 봉우리 나비가 1분과 1.1분일 때 이 관의 단높이는 얼마인가?
- ① 1.0×10-2cm
- ② 1.2×10-2cm
- ③ 1.4×10-2cm
- ④ 1.6×10-2cm
등록된 댓글이 없습니다.
80. 전기량법 적정장치에서 반드시 필요로 하지 않는 것은?
- ① 기체발생장치
- ② 일정전류원
- ③ 정밀한 전자시계
- ④ 적정전지
등록된 댓글이 없습니다.